生体は水をベースに様々な物質が溶けた状態です。今回は物質が液体に溶けることに関して解説します。
溶液
物質が液体に溶けているものを溶液といいます。その液体が水の場合に特に水溶液といいます。生体のことを考えるときは基本的に液体は水ですので水溶液をイメージしてもらえばよいです。
溶液において、溶けている物質のことを溶質、溶かしている液体のことを溶媒といって区別します。
よって次の関係が成り立ちます。
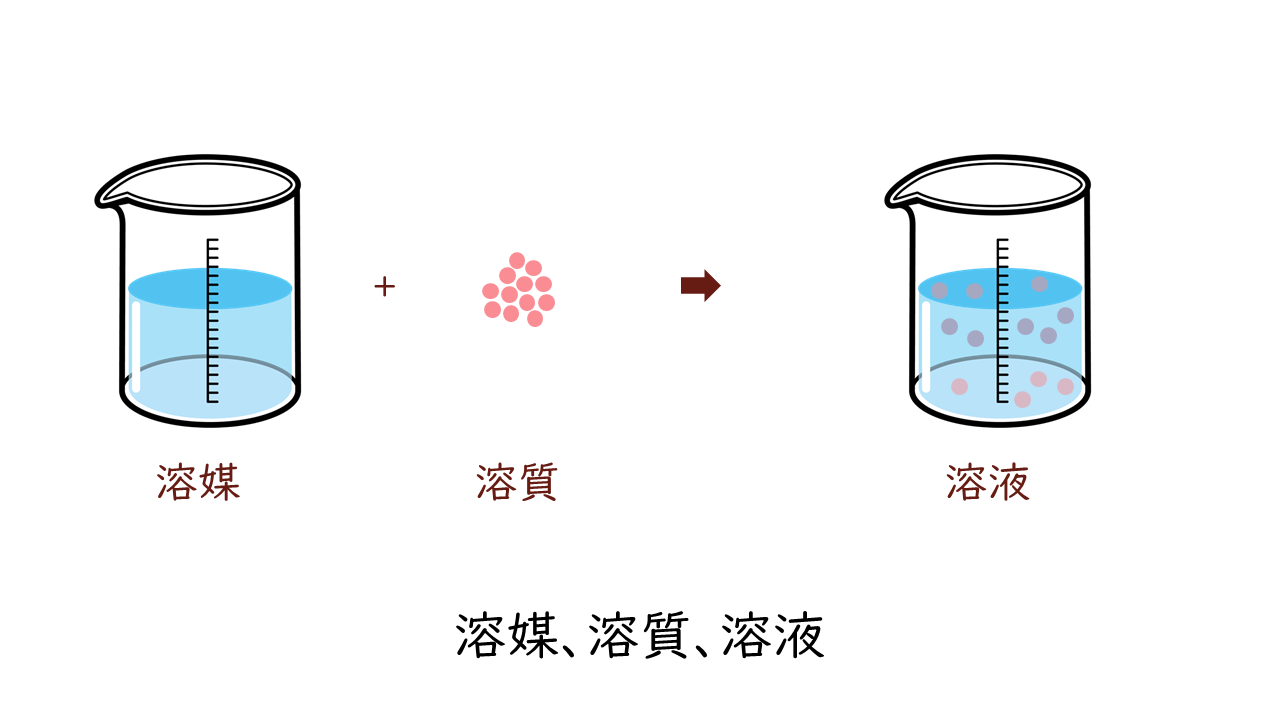
イラスト by 素材工場
ただし、これは質量でみた場合です。体積については必ずしもこうならないことがあります。
親水性、疎水性
車のフロントガラスなどで、水をはじくものと、水がなじむものの違いがあるものがありますよね?
水と触れ合ったときの性質として、水との親和性が高く、水に溶けやすい性質のことを親水性といいます。逆に、水との親和性が低く、水に溶けにくい性質のことを疎水性といいます。
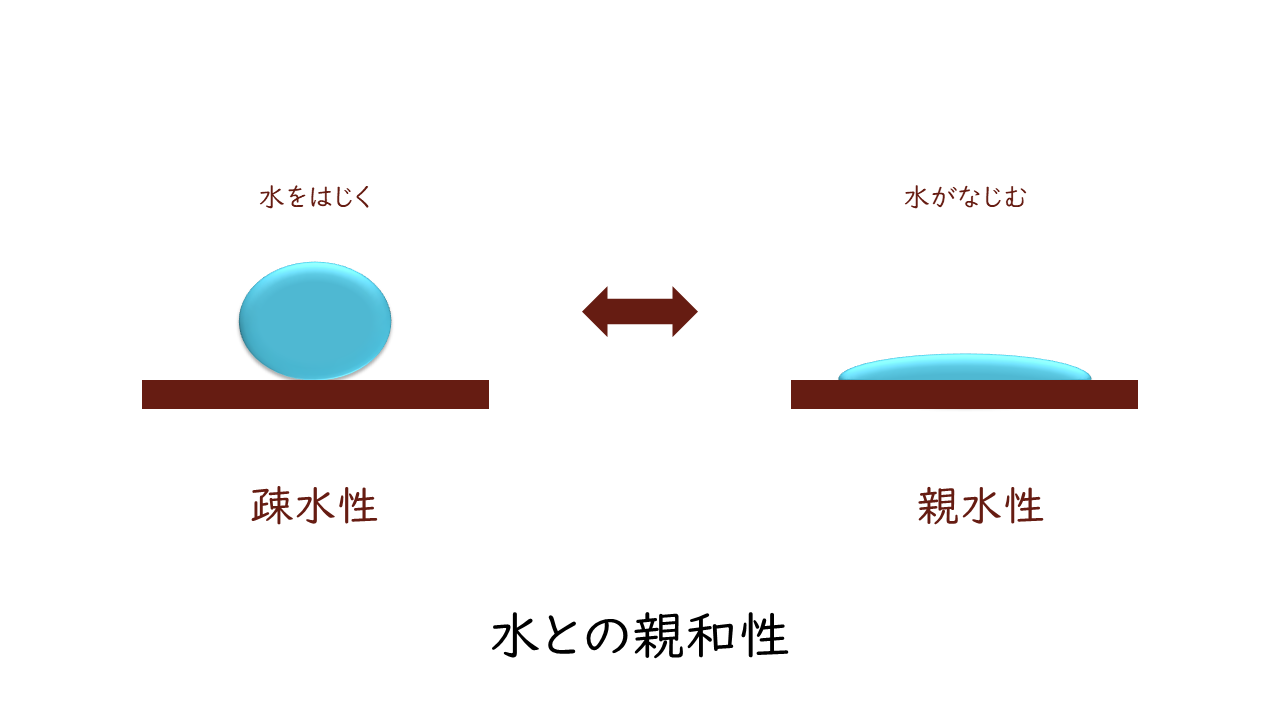
生体では基本的に水が溶媒となっていますので、親水性の物質のほうが溶けやすいものとなります。
生体を構成する物質においては、炭素と水素しかない構造であれば疎水性となり、酸素や窒素やリンなどを含む場合は親水性となります。
モル濃度
次は溶液中の物質の濃度についてです。濃度にはいくつかの種類がありますが、基本的なものとして、質量パーセント濃度とモル濃度があります。
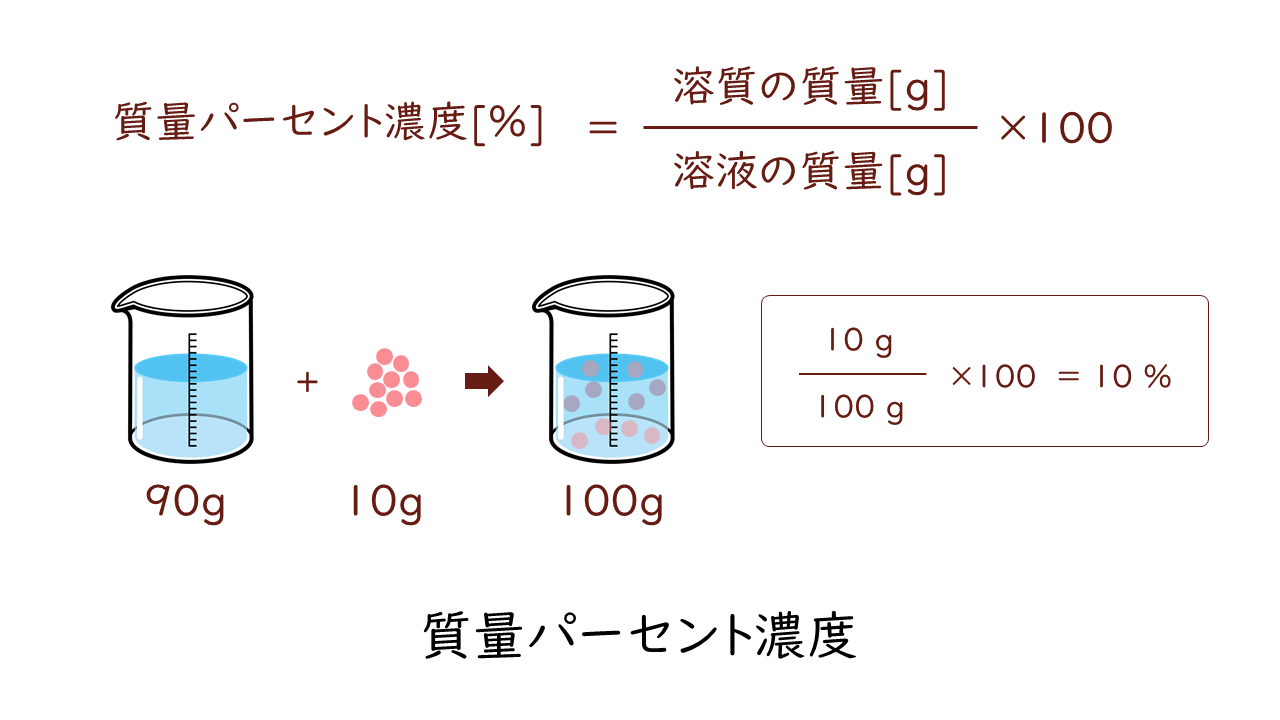
質量パーセント濃度は、溶液全体の質量に対する溶質の質量の割合をパーセントで表す濃度です。
 一方、モル濃度は、溶液1L中に含まれる溶質の物質量(モル数)を表す濃度です。
一方、モル濃度は、溶液1L中に含まれる溶質の物質量(モル数)を表す濃度です。
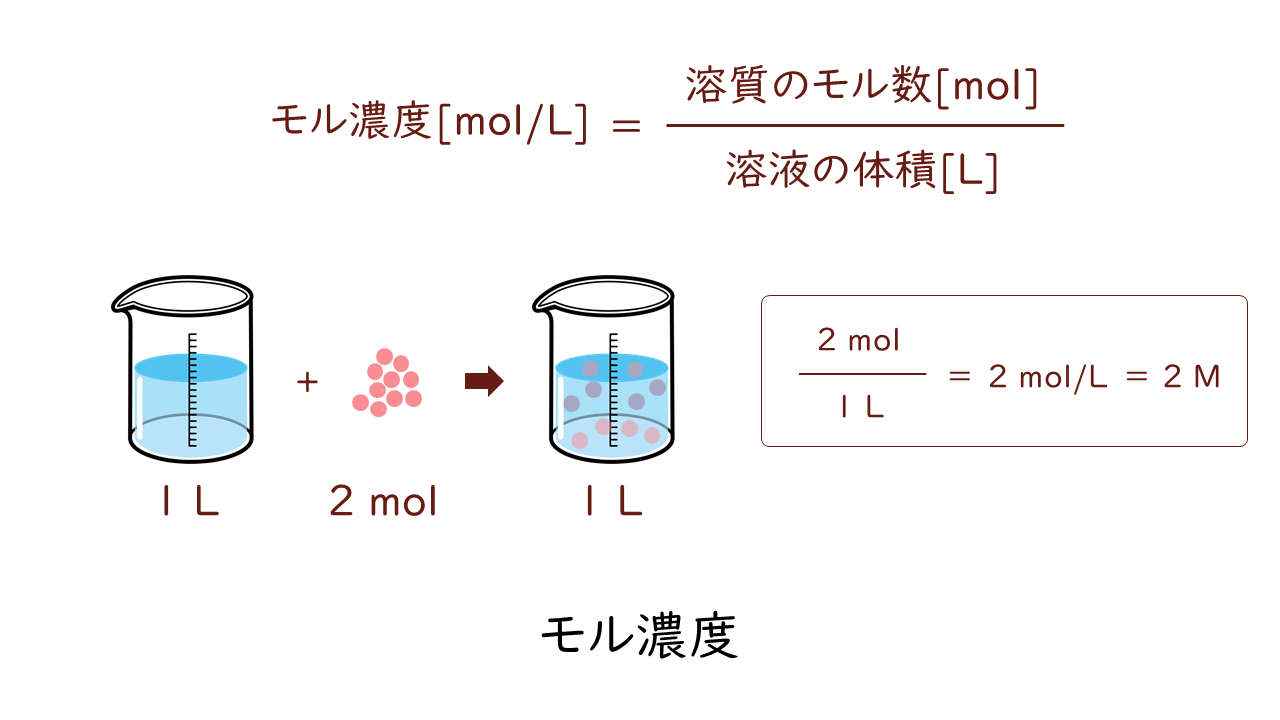
モル濃度の単位は[mol/L]で表しますが、[M](モーラー)で表されることも多いです。
規定度
もうひとつ重要な濃度があります。規定度といって次の式で表されます。
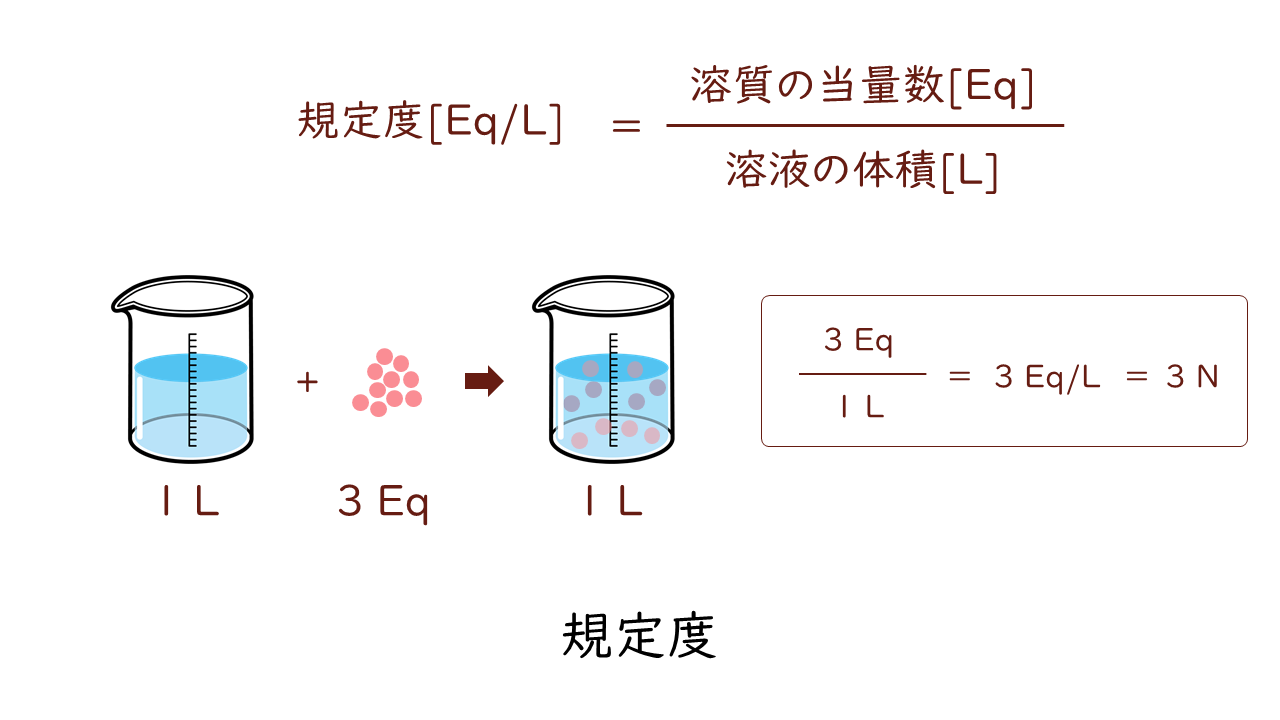 規定度は、溶液1L中に含まれる溶質の当量数を表す濃度です。規定度の単位は[Eq/L]となりますが、[N]で表すことが多いです。
規定度は、溶液1L中に含まれる溶質の当量数を表す濃度です。規定度の単位は[Eq/L]となりますが、[N]で表すことが多いです。
当量数は、H+またはOH–を出す量を表すものです。1モルの酸または塩基がH+またはOH–を1モル出すとき、その酸または塩基1モルは1当量といいます。もし、1モルの酸または塩基がH+またはOH–を2モル出すならば、その酸または塩基1モルは2当量です。
では、次の2つの例を見比べてください。
式量から1mol=36.5gです。これが1Lの水に溶けていれば、1mol/Lでモル濃度は1Mです。
このHClは水に溶けたときに次のように変化します。
HCl → H+ + Cl–
このことから1モルのHClからは1モルのH+が出ることがわかります。すなわち、HClの1モルは1当量であることがわかります。よって、HCl 36.5gが1Lの水に溶けている場合、モル濃度は1M、規定度も1Nとなります。
式量から1mol=98.08gです。これが1Lの水に溶けていれば、1mol/Lでモル濃度は1Mです。
このH2SO4は水に溶けたときに次のように変化します。
H2SO4 → 2H+ + SO42-
このことから1モルのH2SO4からは2モルのH+が出ることがわかります。すなわち、H2SO4の1モルは2当量であることがわかります。よって、H2SO4 98.08gが1Lの水に溶けている場合、モル濃度は1M、規定度は2Nとなります。
今回のポイント
- 物質が溶解して均一になった液体を溶液といいます。このとき、物質を溶かしている液体を溶媒、溶けている物質を溶質といいます。溶液のうち、溶媒が水のものを水溶液といいます。
- 水との親和性が高く、水に溶けやすい性質を親水性、水との親和性が低く、水に溶けにくい性質を疎水性といいます。生体では基本となる溶媒が水であるため、親水性の物質が溶けやすくなります。
- 溶液1L中に含まれる溶質の物質量で表す濃度をモル濃度といいます。単位はM(モーラー)、mol/L
- 溶液1L中に含まれる溶質のグラム当量数を規定度といいます。単位はN。1モルの酸または塩基がH+またはOH–を1モル出すとき、その酸または塩基1モルは1当量であり、1当量の質量を1グラム当量といいます。







