生化学講義の初回は、まず生化学の学習を始めるにあたって、知っておきたい最低限の化学の知識を解説します。
確かに「化学」そのもの自体が奥深くて難解な領域もありますが、生化学に「化学」という文字が含まれるように、生化学を根本的に理解するためには化学の知識が欠かせません。
ここでは生化学を理解するために絶対に知っておいて欲しい化学の基礎的な内容を厳選してまとめました。といっても、高校で学習する内容が中心ですので「すでに知っている」「わかっている」という内容も多いかと思います。知っていたことは復習として、知らなかったことはこれをきっかけにして、しっかりと理解していきましょう!
分子のでき方
あらゆる物質は細かく分解してみると、原子の組合せでできています。いくつかの原子が集まって分子を形成することが物質を形作る第一歩です。では、原子が分子を形成するときにどのようにしてくっつくかというと、その代表的な仕組みが共有結合です。
共有結合はある原子と別の原子が電子を共有することによってくっつく仕組みです。
水素分子の例を見てみましょう。
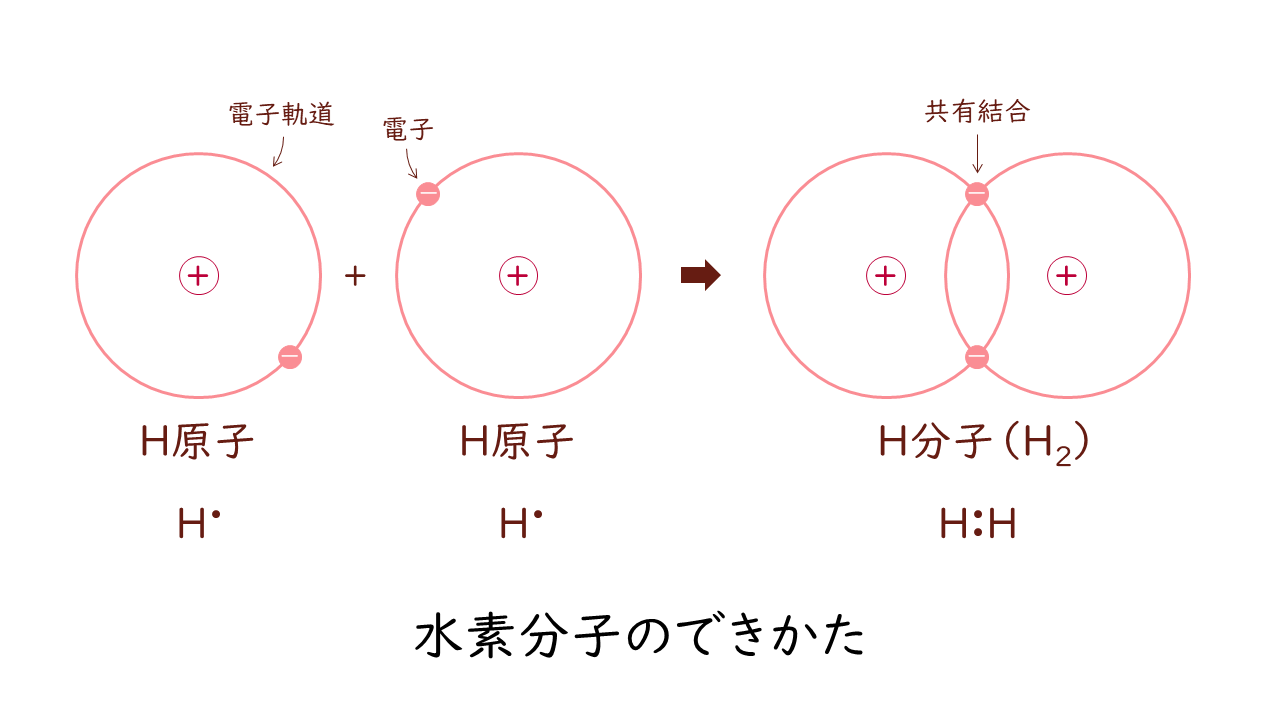
1つの水素(H)原子は1つの電子を持っています。2つの水素原子が共有結合するとき、お互いの電子軌道を重ね合わせるようにして、1つの水素原子が2つの電子をもっているような形に落ち着きます。このように電子を共有しあって形成する結合を共有結合といいます。
共有結合は、生命を構成する物質を形作る最も基本的な結合です。共有結合を理解することは生体物質の成り立ちを理解することにつながります。
原子の価数
共有結合は原子がもっている電子を使って結合します。原子の種類によってもっている電子の数が異なりますので、原子の種類によって結合できる相手の数が変わってきます。(本当はもう少し複雑な仕組みがありますが、初心者向けに難しいことは触れずに、イメージを重視して説明します。)
そこで、重要なのは原子の価数です。原子の価数は結合の手の数に例えられます。主な原子の価数は次のとおりです。
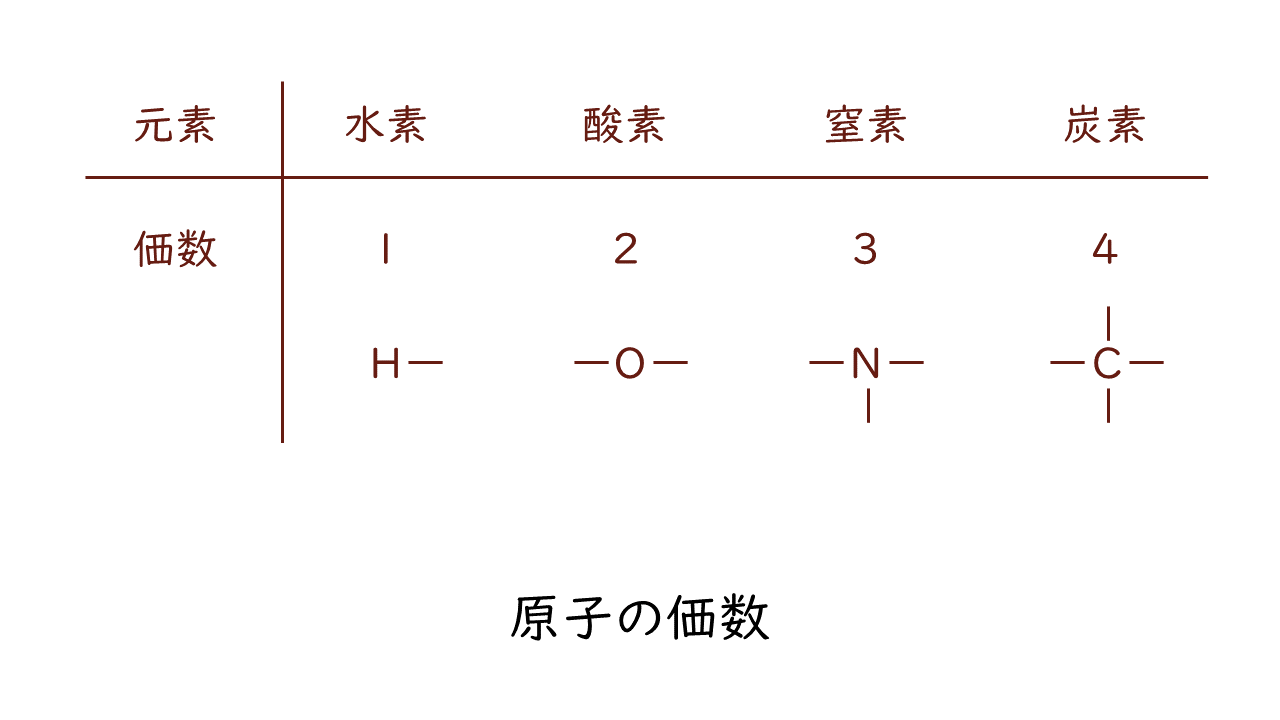
ここにある原子の価数はとても重要ですので、しっかりと覚えておきましょう。
配位結合
共有結合では2つの原子がお互いに電子を出し合って共有するのが基本ですが、例外的に一方の原子からだけ電子を出す形で結合する特殊な共有結合があります。これを配位結合といいます。
配位結合では片方の原子がもつ非共有電子対を利用してつながります。
アンモニウムイオンの例を見てみましょう。
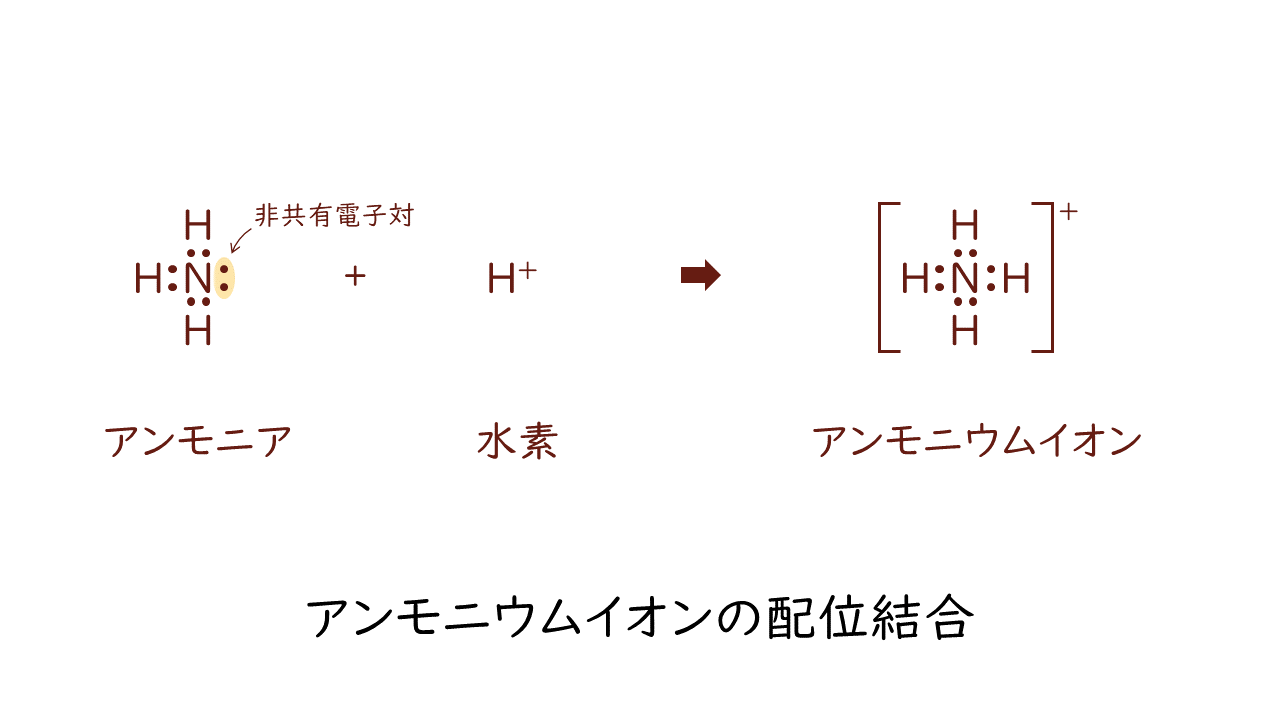
アンモニア(NH4)はすでにN(窒素)にH(水素)が3つ結合した状態です。これは通常の共有結合によるものです。この状態でよく見ると、N(窒素)にはまだ結合に使われていない電子が2つ余っているように見えます。これが非共有電子対です。この非共有電子対に対し、H(水素)が電子を提供しないまま結合したものがアンモニウムイオン(NH4+)です。
錯イオン
配位結合は非共有電子対をもつ分子と金属イオンとの間で形成されることがあります。
このようにしてできたイオンを錯イオンといい、錯イオンを含む化合物を錯体といいます。
金属イオンからみて配位結合する相手を配位子といい、主な配位子には以下のようなものがあります。
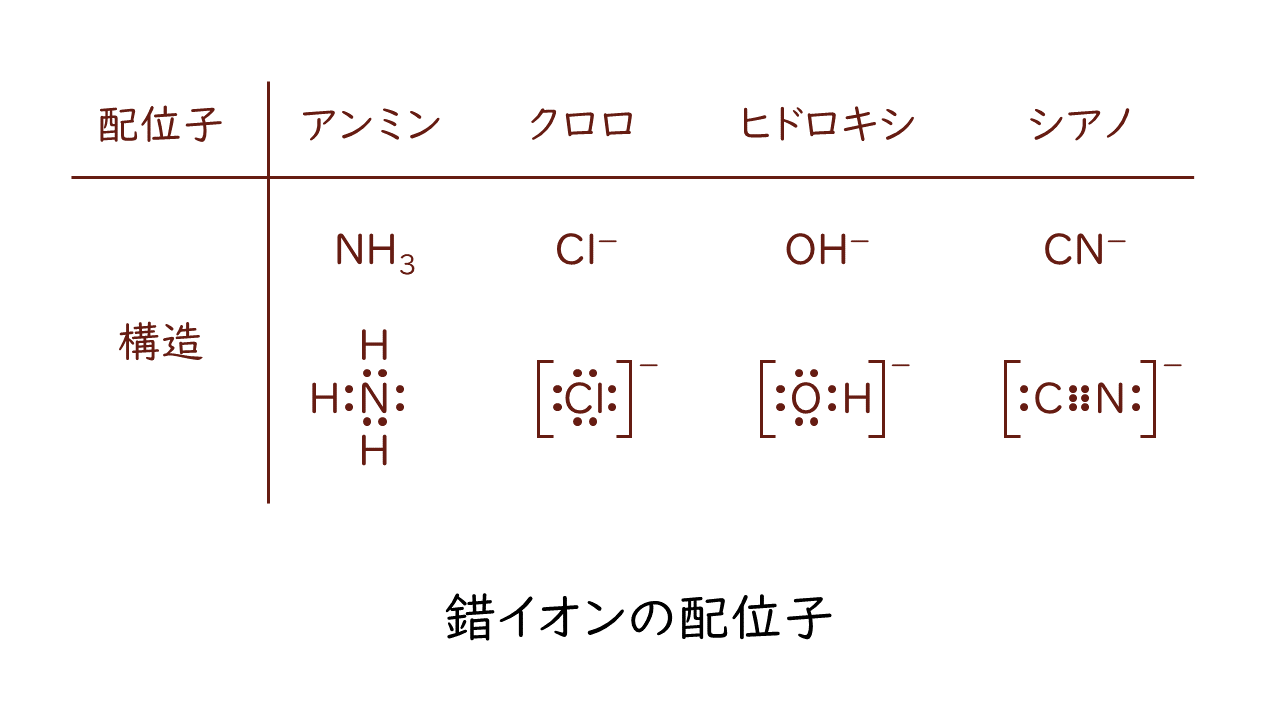
生体内には微量の金属がありますが、これらの配位子と結合した状態で存在することが多いです。
水素結合
ここからは共有結合以外の化学結合を見ておきましょう。
生体は水をベースとして成り立っています。その水の性質を決めている大きな要素が水素結合です。
水分子の様子を見てみましょう。
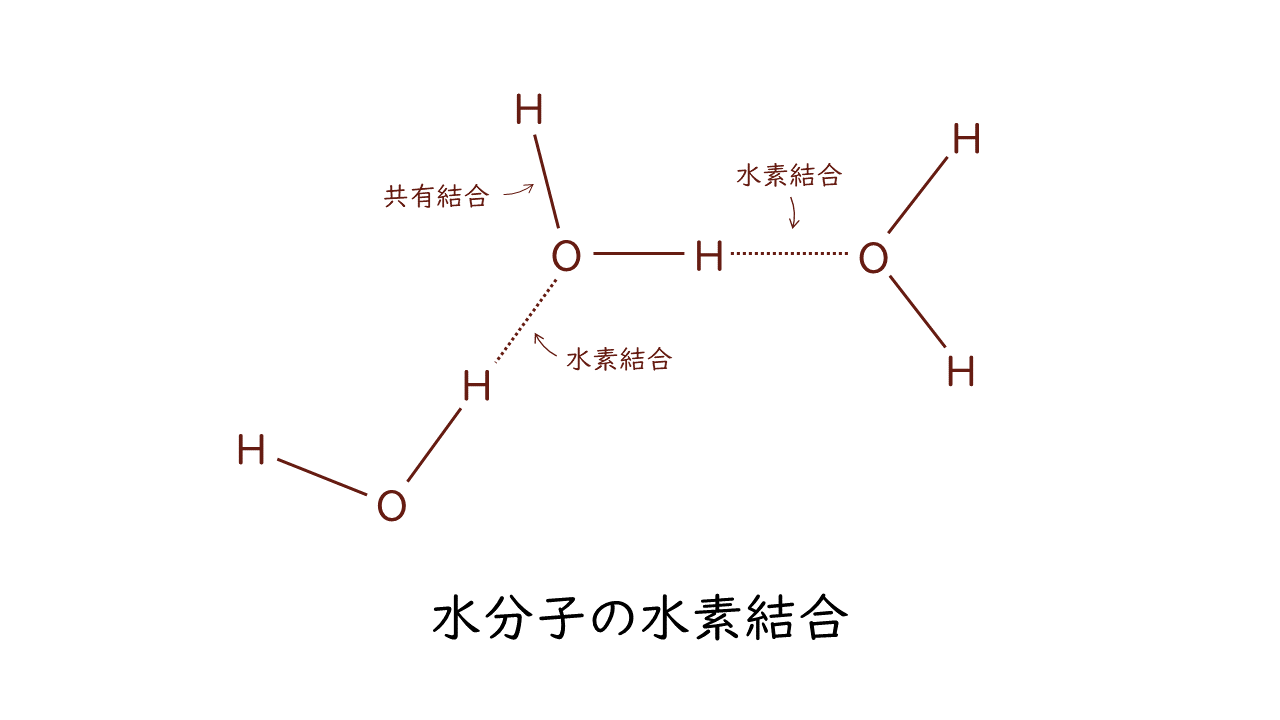
水分子(H2O)を構成するH(水素)とO(酸素)が微妙な力で引きあっています。この結合が水素結合です。水素結合は、O(酸素)やN(窒素)など電気陰性度の大きい原子どうしの間において、水素原子が介在することで生じる結合です。
水素結合は共有結合に比べてはるかに弱い結合ですが、生命活動にとっては欠かせない水の性質を決めています。
ファンデルワールス力
水素結合よりもさらに弱い化学結合もあります。分子と分子の間には、その分子量の大きさに応じて、微弱な引力が作用しています。これをファンデルワールス力といいます。
水素結合やファンデルワールス力は、共有結合における電子のように互いをつなぐものが明確に存在しません。このような分子と分子の間に働く力のことを分子間力といいます。
化学結合の比較
化学結合の引力を比較すると次のような大小関係があります。
共有結合 ≒ イオン結合 > 水素結合 > ファンデルワールス力
当然のことながら化学結合が引力が強いものは、弱いものに比べて、切れにくくなります。このことを知っておくと、生体内での化学反応を理解するときにも役立ってきます。
今回のポイント
- 原子どうしが電子を共有することによる結合を共有結合といいます。共有結合で分子をつくるとき、構成原子がもつ不対電子の数(価数)がいわゆる結合の手の数です。
- 片方の原子のみが非共有電子対を出してできる特殊な共有結合を配位結合といいます。配位結合によって生じるイオンに錯イオンがあります。
- 電気陰性度の大きい原子間に水素原子が介在して生じる結合を水素結合といいます。
- 分子間には弱い引力が作用しています。この引力をファンデルワールス力といい、一般に分子量の大きい分子ほど強く作用します。ファンデルワールス力や水素結合などの、分子間に働く相互作用を総称して分子間力といいます。







質問はこちらへ