気になる生化学シリーズ、今回は酵素の3回目として、酵素反応速度論のお話です。
少し難しい分野ですが、数式は最小限にしながら酵素反応速度の変化をお話したいと思います。
今回のクエスチョンはこちら、
- 反応速度と基質濃度との関係は?
- ミカエリス定数とは?
- 阻害剤はどのように酵素反応を阻害するの?
- 酵素活性の単位は?
こうした問いに答えられるよう解説したいと思います。
基質濃度と反応速度
酵素の作用を受けて、基質から酵素-基質複合体を経て生成物ができる反応は次の式で表されます。
$$\mathrm{E}+\mathrm{S}\, ⇄ \, \mathrm{ES}\, \longrightarrow \, \mathrm{E}+\mathrm{P}$$
(E:酵素、S:基質、ES:酵素-基質複合体、P:生成物)
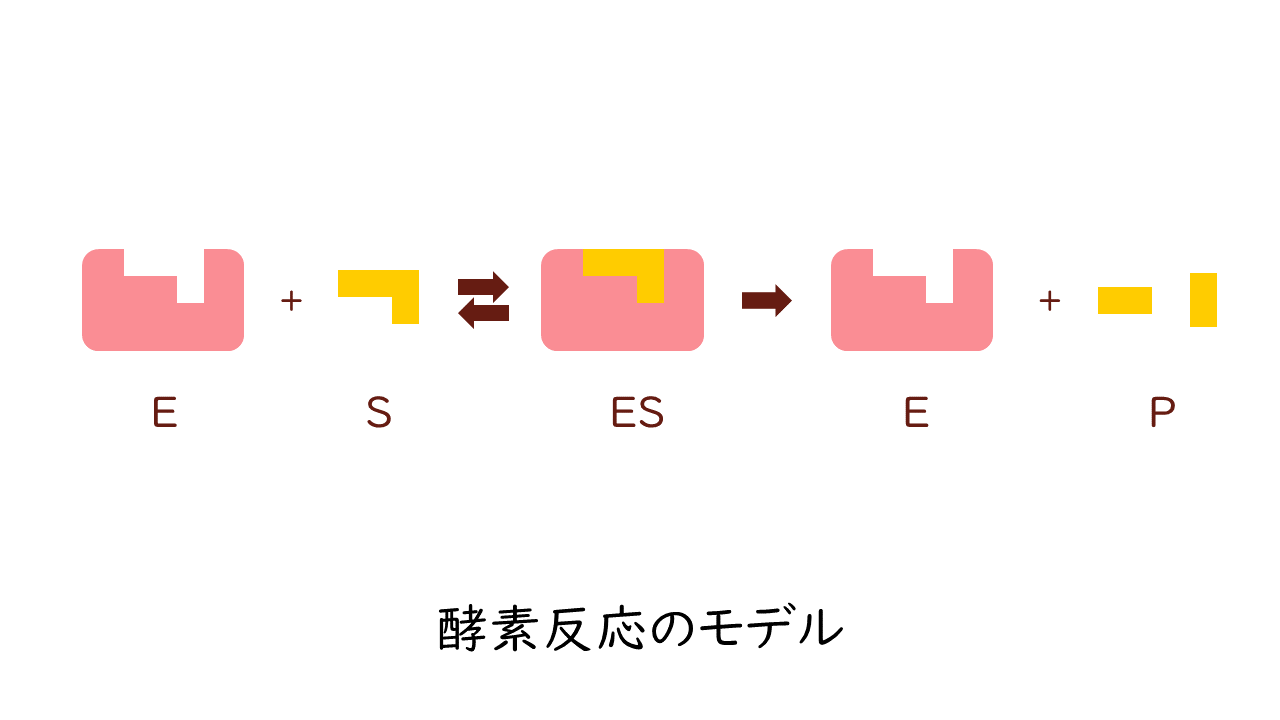
酵素(E)は反応の前後で変化しないものでしたね。
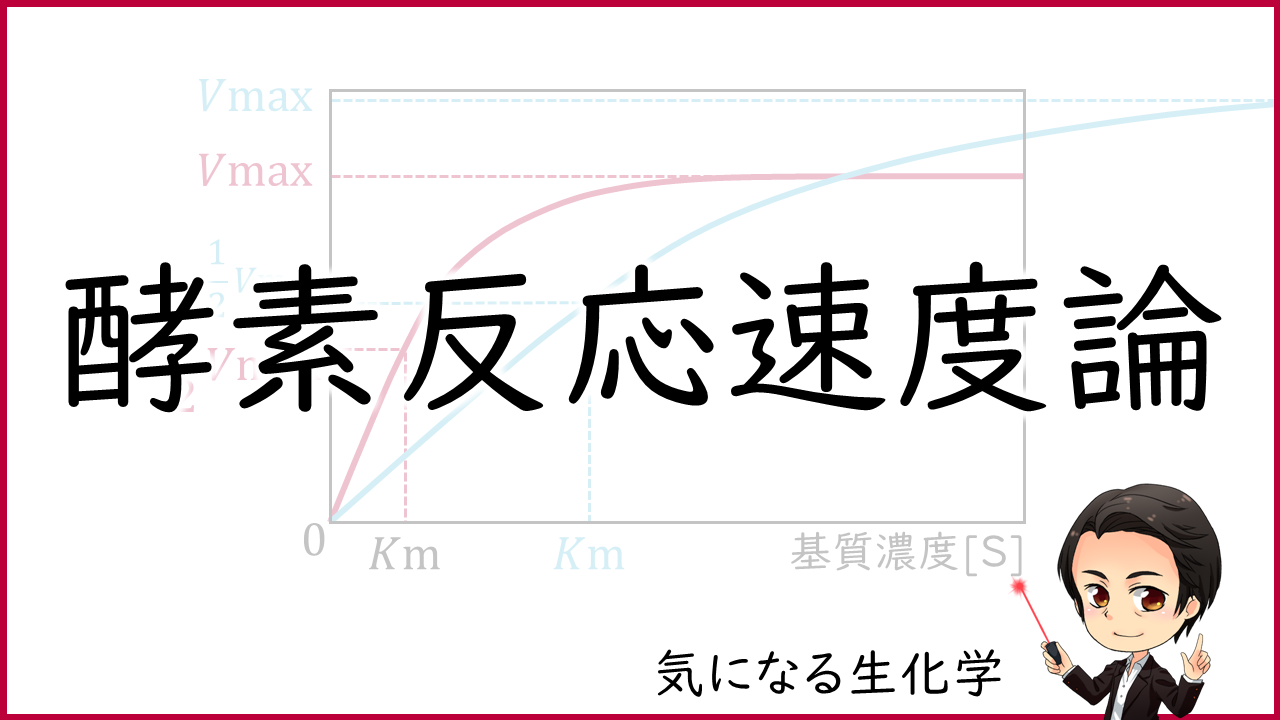
こうした酵素反応において、酵素量をある一定の量に固定した場合、反応速度と基質濃度の関係は双曲線状に変化し、ある一定の基質濃度以上では反応速度が最大反応速度で一定になります。
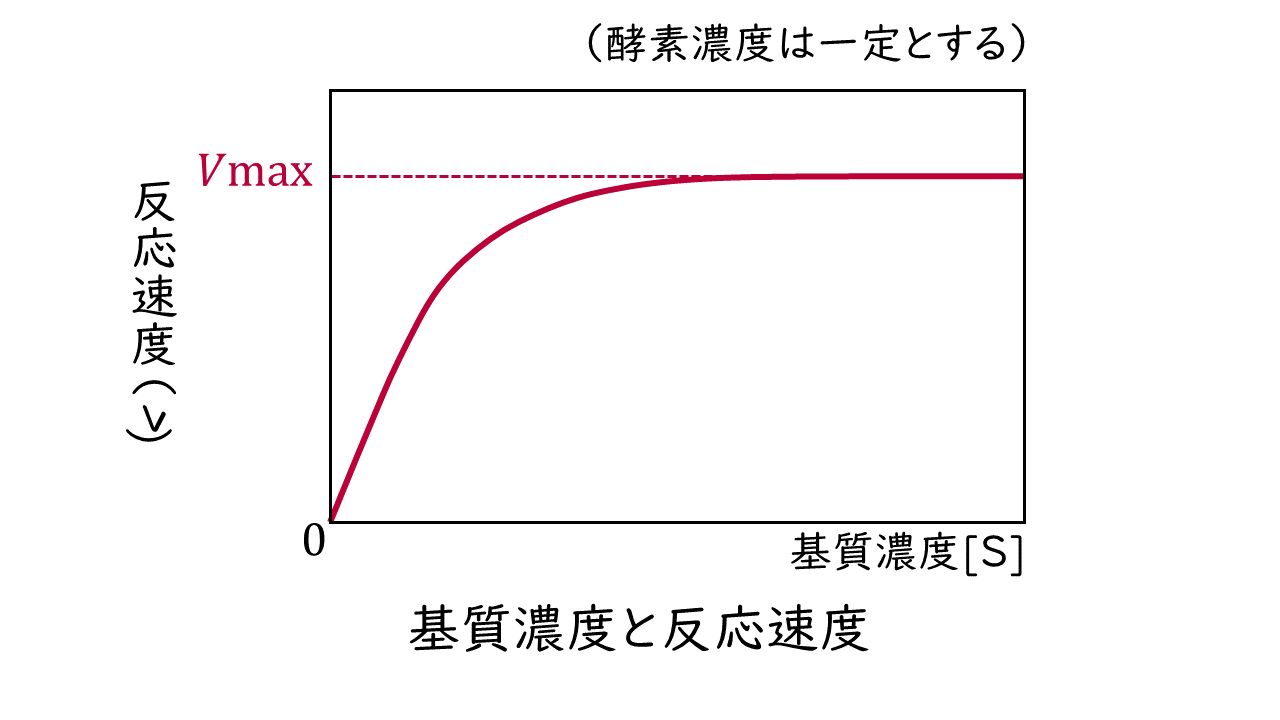
このような反応速度と基質濃度の関係は、次のミカエリス・メンテンの式で表されます。なお、基質(S)の濃度を[S]と表します。
ミカエリス・メンテンの式:
$$v=\frac{Vmax\times[\mathrm{S}]}{Km+[\mathrm{S}]}$$
(v:反応速度、Vmax:最大反応速度、[S]:基質濃度、Km:ミカエリス定数)
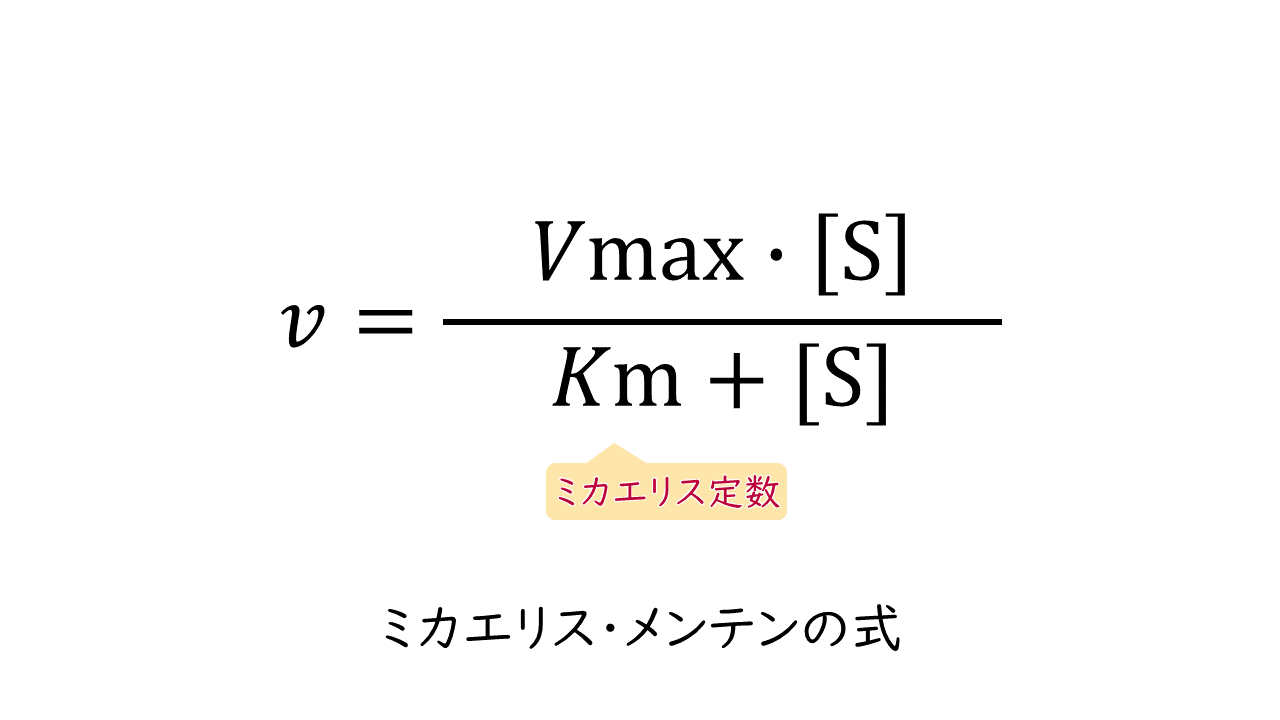
ミカエリス定数(Km)は、酵素それぞれの特性を表す固有の値です。Km値が小さいほど酵素と基質の親和性が高く、逆にKm値が大きいほど酵素と基質の親和性が低いことを意味します。
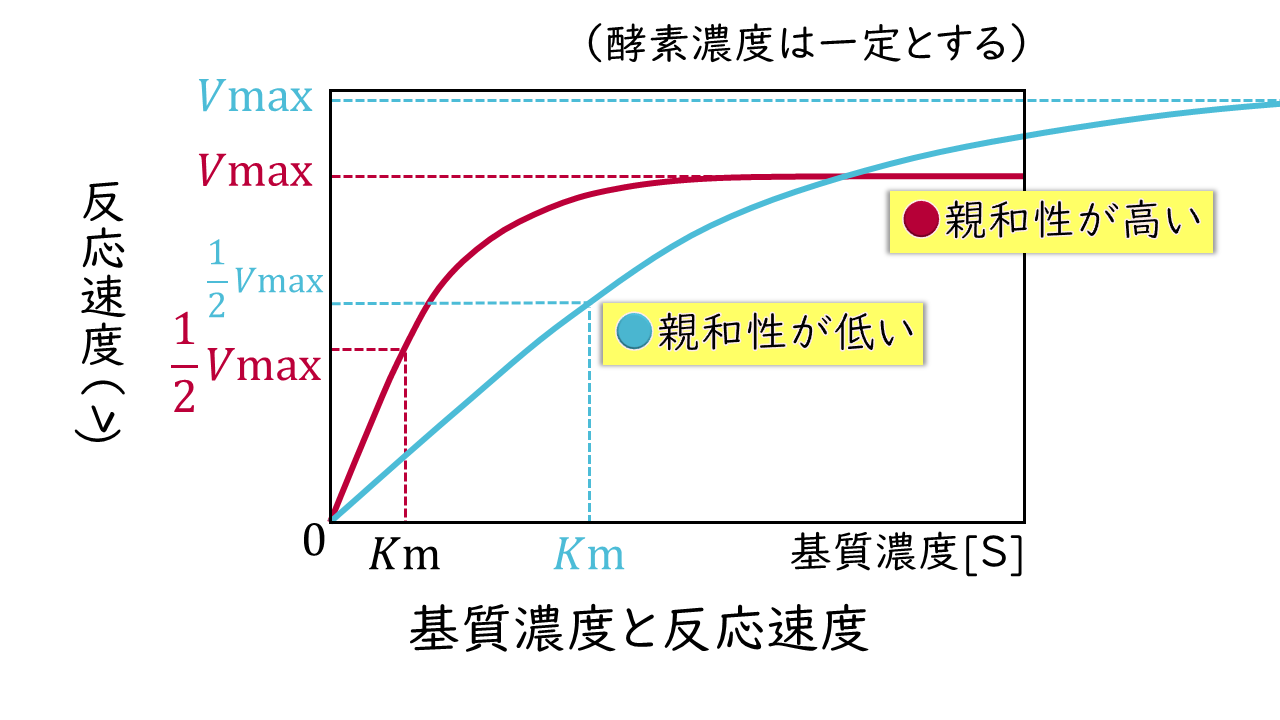
酵素反応では、酵素と基質は1対1で結合しますので、酵素に比べて基質が少なければ酵素が余っている状態、逆に酵素に比べて基質が多ければ基質が余る状態が生じます。
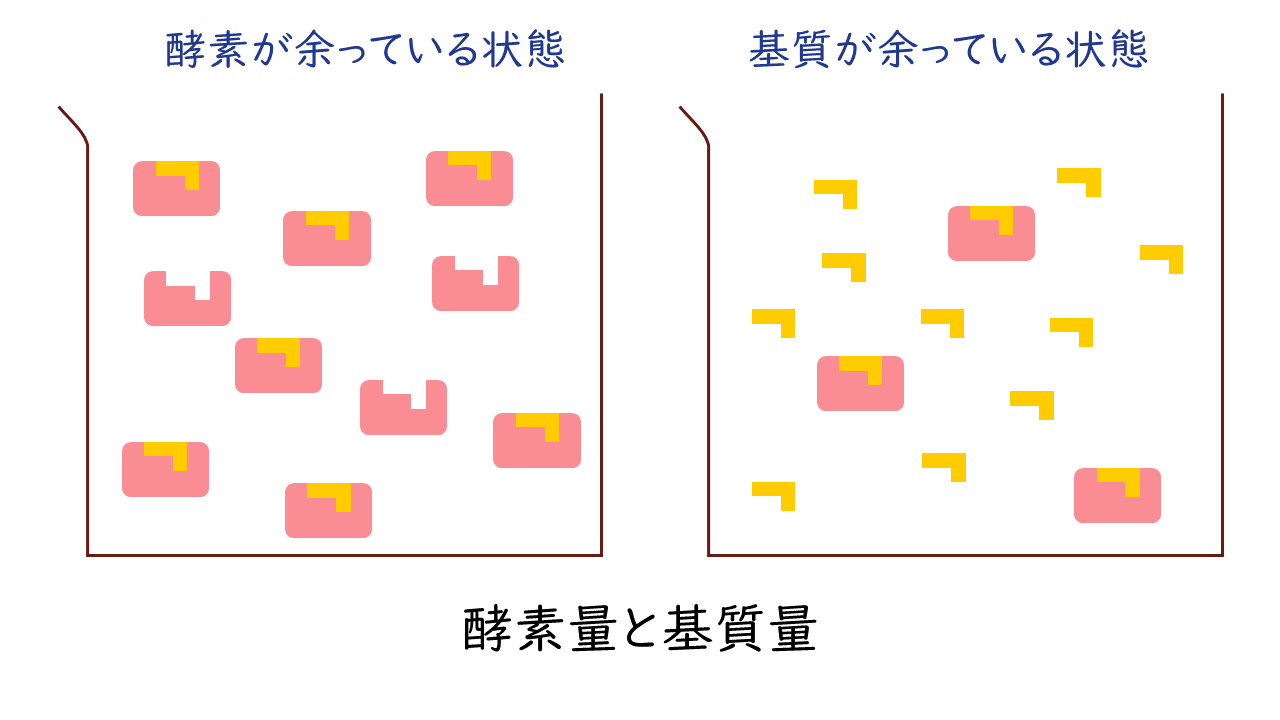
こうしたことから、反応速度(v)は、Km値と基質濃度[S]の大小関係によって、次の3つの状況にわけて表すことができます。
1.基質濃度[S]がKm値よりもかなり小さいとき
Kmに比べて[S]がかなり小さいときは、ミカエリス・メンテンの式の分母(Km+[S])がKmで近似できるため、反応速度(v)は次の式で表されます。
$$v=\frac{Vmax}{Km}\times[\mathrm{S}]$$
この式において、Vmax/Kmは特定の値となりますので、反応速度(v)は基質濃度[S]に比例することがわかります。このような状態を一次反応といいます。
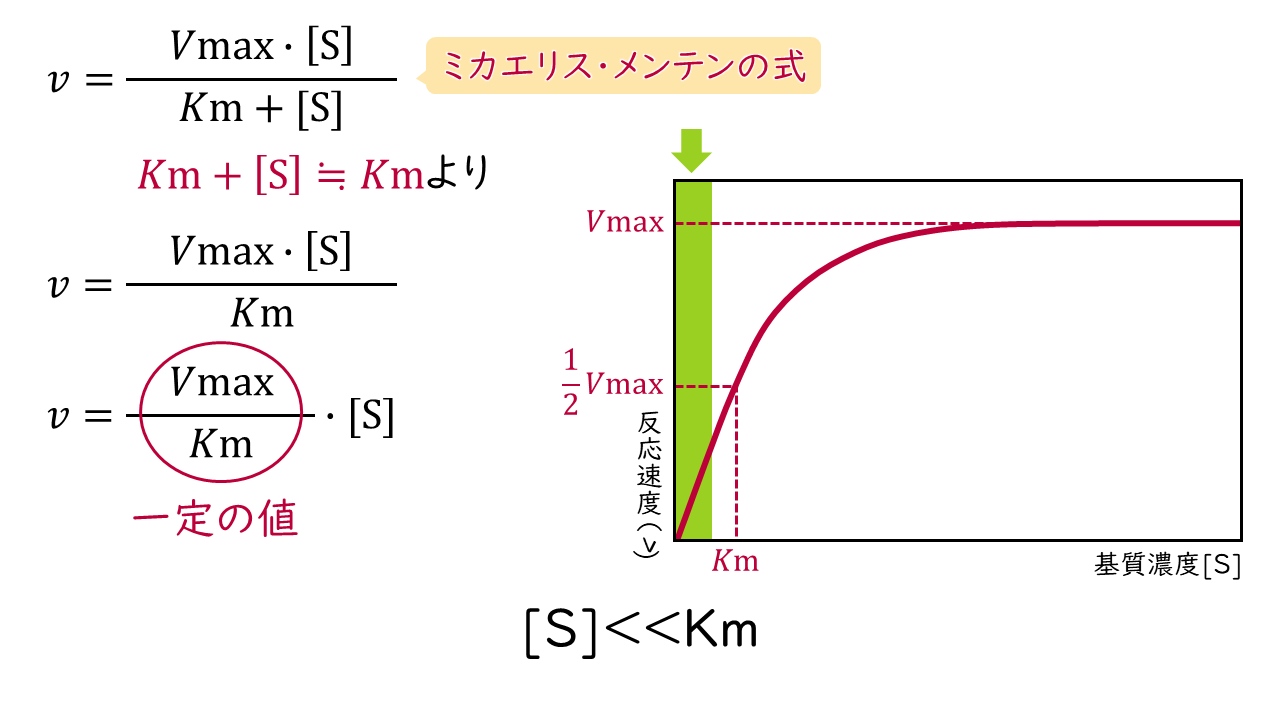
反応速度:基質濃度に比例
→一次反応
2.基質濃度[S]がKm値と等しいとき
Kmと[S]が等しいとき、ミカエリス・メンテンの式の分母(Km+[S])が[S]+[S]=2[S]となるため、反応速度(v)は次の式で表されます。
$$v=\frac{Vmax}{2}$$
この式から、Km値は反応速度がVmaxの半分になるときの基質濃度に等しいことがわかります。
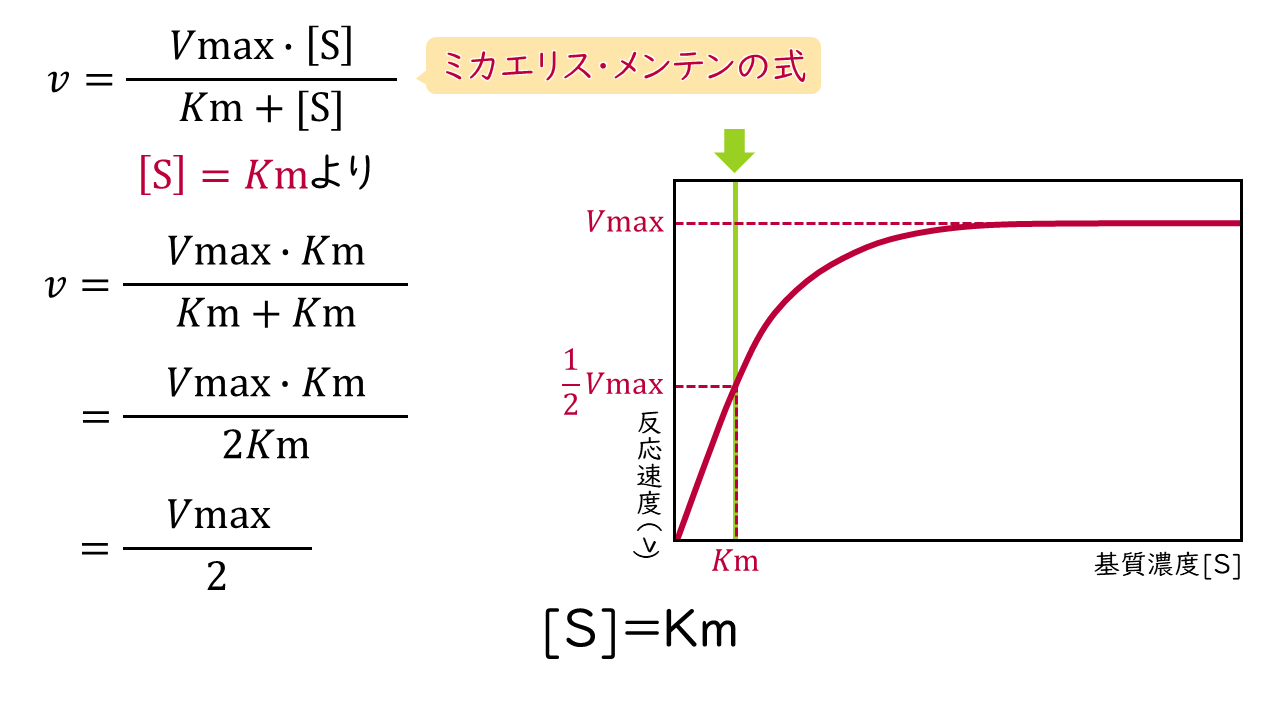
反応速度:Vmaxの1/2
3.基質濃度[S]がKm値よりも十分に大きいとき
Kmに比べて[S]が十分に大きいときは、ミカエリス・メンテンの式の分母(Km+[S])が[S]で近似できるため、反応速度(v)は次の式で表されます。
$$v=Vmax$$
この式から、反応速度(v)は基質濃度[S]にかからず常に最大反応速度(Vmax)になることがわかります。このような状態を零次(0次)反応といいます。
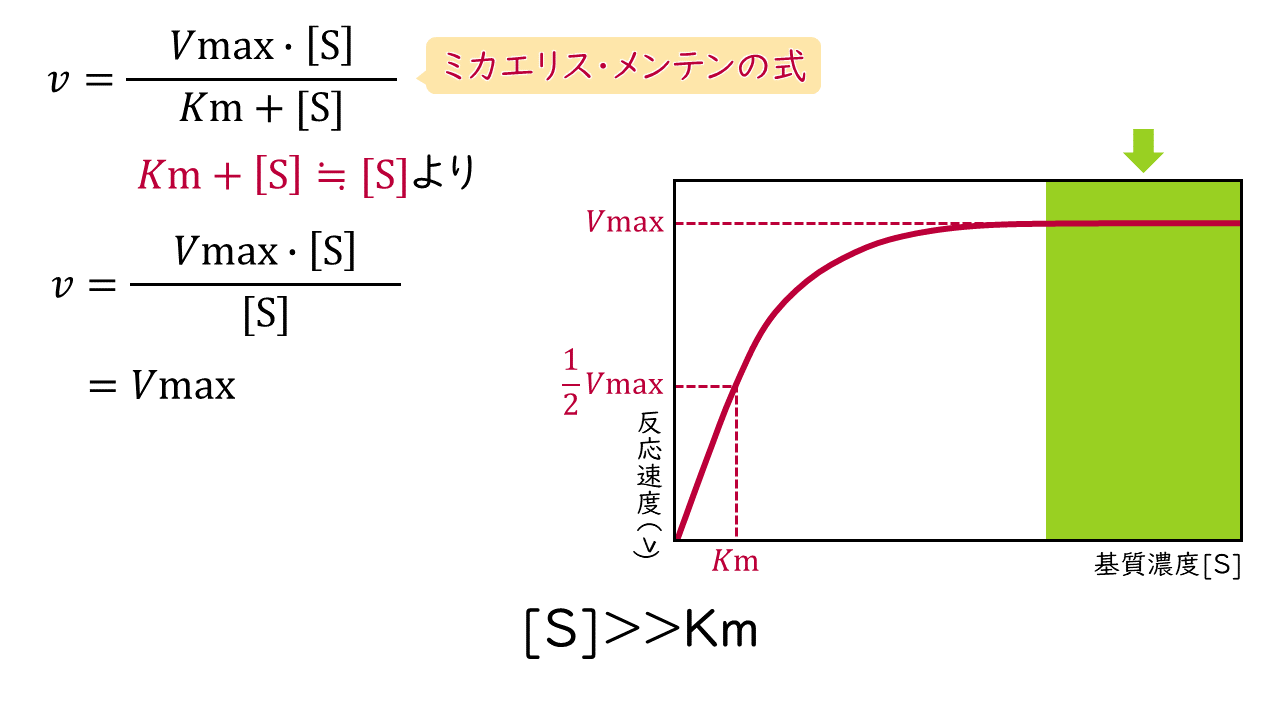
反応速度:基質濃度に関係なく一定(Vmax)
→零次(0次)反応
KmおよびVmaxの測定
ミカエリス・メンテンの式の逆数をとって変形すると、次のラインウィーバー・バークの式が求まります。
ラインウィーバー・バークの式:
$$\frac{1}{v}=\frac{Km}{Vmax}\times\frac{1}{[\mathrm{S}]}+\frac{1}{Vmax}$$

ラインウィーバー・バークの式は、KmおよびVmaxを実験的に測定するときに用いられます。
基質濃度[S]を変えながら反応速度(v)を測定し、横軸に1/[S]、縦軸に1/vをとってプロットしたグラフを二重逆数プロットといいます。これらのプロットを通る直線を描いたとき、この直線と横軸との交点が-1/Km、縦軸との交点が1/Vmax、傾きがKm/Vmaxとなることが、ラインウィーバー・バークの式よりわかります。これを利用して、KmおよびVmaxが求められます。
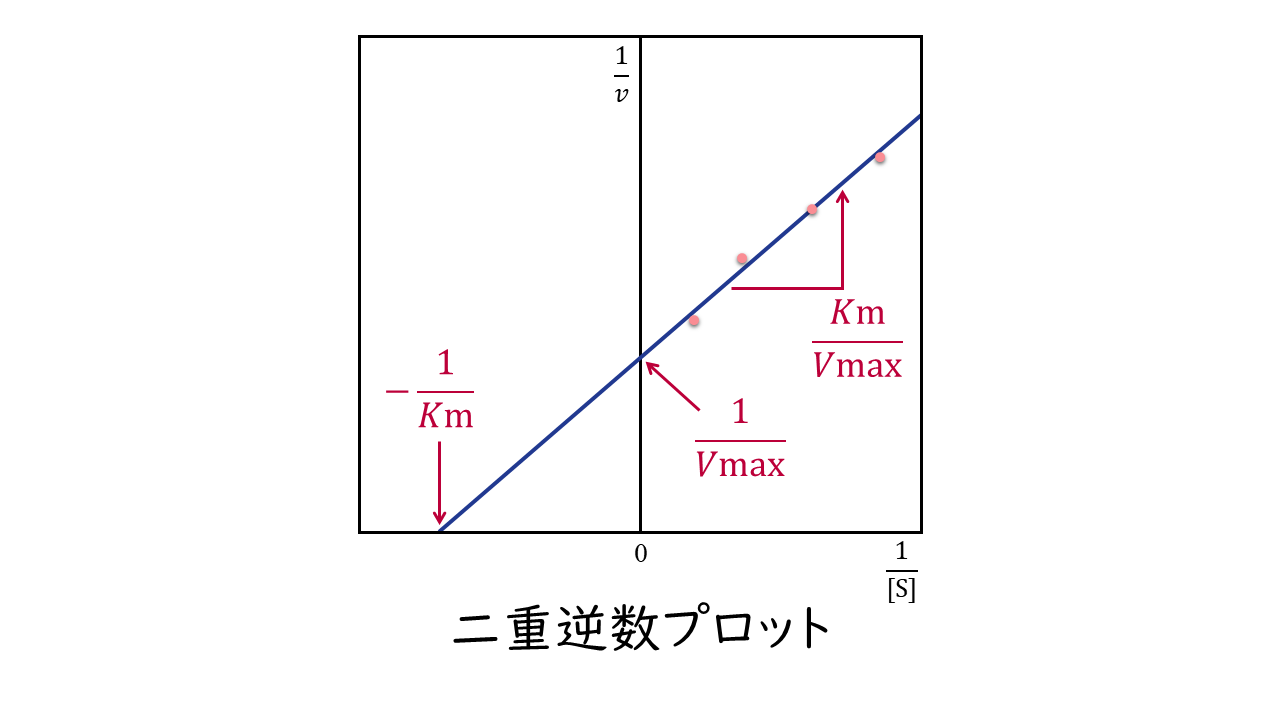
横軸との交点:-1/Km
縦軸との交点:1/Vmax
傾き:Km/Vmax


酵素反応の阻害
酵素反応の進行を妨げることを阻害といい、これに寄与する化合物を阻害剤といいます。
阻害の種類として、競合阻害、非競合阻害、不競合阻害があり、それぞれに酵素反応速度の振る舞いが異なります。
1.競合阻害
阻害剤が、基質と同一の酵素の部位(活性中心)に結合することによって酵素反応を阻害するものを競合阻害といいます。
競合阻害では、基質と阻害剤が酵素の活性中心を奪いあうため、基質と酵素の親和性が低くなります。よって、阻害剤がないときに比べKm値が大きくなります。
一方、阻害剤に比べて基質が十分に多く存在するときには、酵素はもっぱら基質とのみ反応することになりますので、最大反応速度Kmは阻害剤がないときと変わりません。
このとき二重逆数プロットの変化は次のようになります。
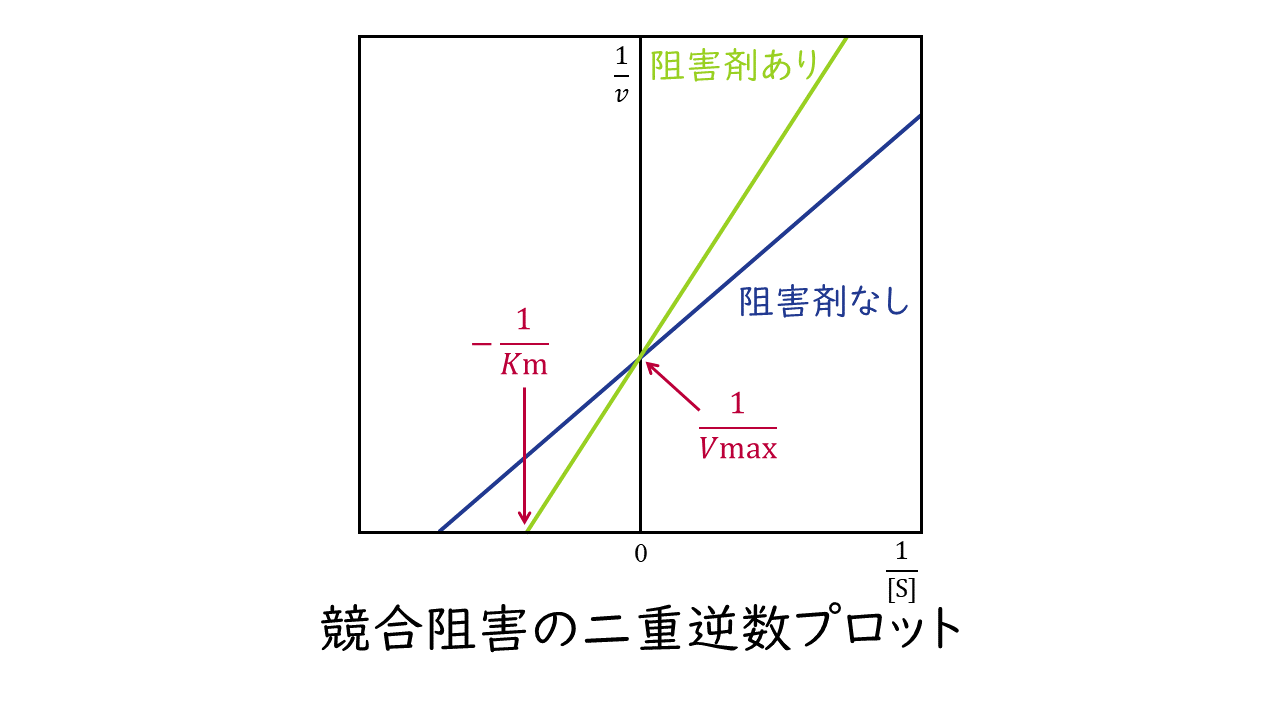
阻害剤の結合部位:基質と同一の酵素の部位(活性中心)
Kmの変化:大きくなる
Vmaxの変化:変わらない
2.非競合阻害
阻害剤が、基質と異なるの酵素の部位に結合することによって酵素反応を阻害するものを非競合阻害といいます。
非競合阻害では、阻害剤は基質と酵素の結合には影響しませんので、基質と酵素の親和性は阻害剤がないときと変わりません。よって、Km値は変わりません。
一方、阻害剤に比べて基質が十分に存在する場合でも、阻害剤は酵素に結合し反応を妨げることができますので、最大反応速度Kmは阻害剤がないときに比べて小さくなります。
このとき二重逆数プロットの変化は次のようになります。
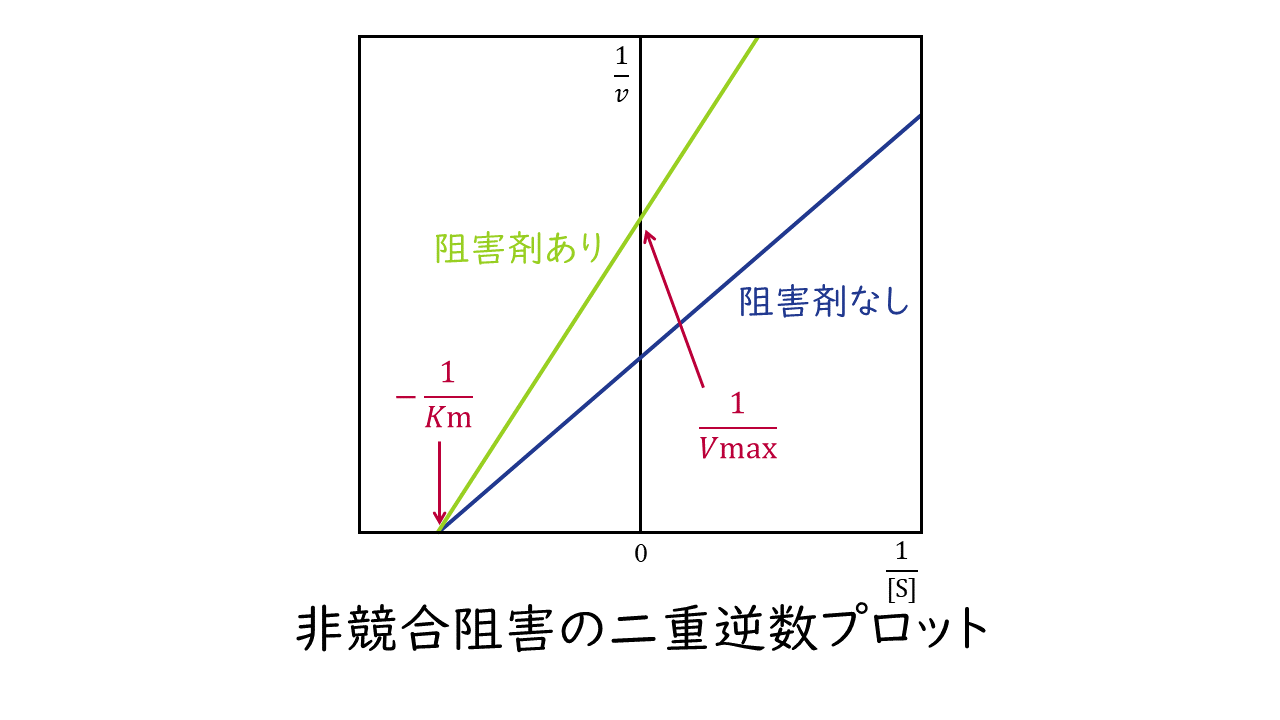
阻害剤の結合部位:基質と異なる酵素の部位
Kmの変化:変わらない
Vmaxの変化:小さくなる
3.不競合阻害
阻害剤が、酵素-基質複合体に結合することによって酵素反応を阻害するものを不競合阻害といいます。
不競合阻害では、基質と酵素が結合したところに阻害剤が結合しますので、基質と酵素の親和性が高くなります。よって、阻害剤がないときに比べKm値が小さくなります。
また、阻害剤に比べて基質が十分に存在する場合でも、阻害剤は酵素-基質複合体に結合し反応を妨げることができますので、最大反応速度Kmは阻害剤がないときに比べて小さくなります。
このとき二重逆数プロットの変化は次のようになります。
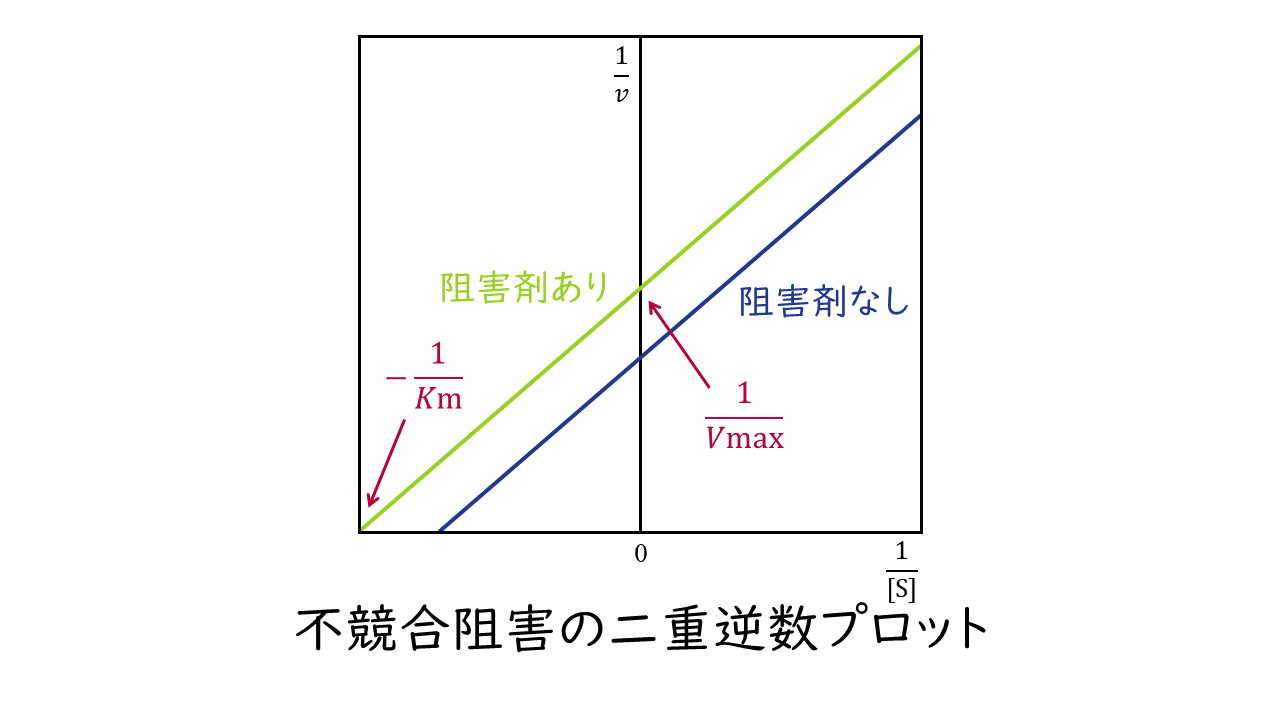
阻害剤の結合部位:酵素-基質複合体
Kmの変化:小さくなる
Vmaxの変化:小さくなる
酵素活性の測定と単位
酵素の量は、物質としての質量ではなく、酵素活性の強さ(触媒作用の強さ)で表します。
酵素活性の強さは、一定時間あたりの反応量で測定します。
国際単位(IU)では、1分間に1 μmolの基質を変化させる酵素量を1 U(1 unit、1単位)と定めています。
また、SI単位では、1秒間に1 molの基質を変化させる酵素量を1 katalとします。ほかに、酵素1 mg当たりの単位時間の基質変化量を比活性といいます。
酵素活性は測定する条件によって変化しますので、次のような一定の条件下で行う必要があります。
- 一定の温度(最適温度)で測定する
- 最適pHが保たれるよう緩衝液中で測定する
- 十分に高い基質濃度で最大反応速度を測定する(零次反応)
- 反応時間と生成物量が比例するように反応初速度を測定する
- 必要な補因子(補酵素や金属イオン)を加えて測定する


今回のポイント
基質濃度と反応速度
- 酵素の作用を受けて基質から酵素-基質複合体を経て反応生成物ができる反応は次の式で表される。
E + S ⇄ ES → E + P (E:酵素、S:基質、ES:酵素-基質複合体、P:生成物) - 酵素量が一定のとき、反応速度と基質濃度の関係は双曲線状に変化する。
- 反応速度と基質濃度の関係は次のミカエリス・メンテンの式で表される。
ミカエリス・メンテンの式:v=(Vmax×[S])/(Km+[S])
(v:反応速度、Vmax:最大反応速度、[S]:基質濃度、Km:ミカエリス定数)
ミカエリス定数(Km)は、酵素それぞれの特性を表す固有の値。Km値が小さいほど酵素と基質の親和性が高いことを意味する。Km値は反応速度がVmaxの半分になるときの基質濃度に等しい。 - 反応速度は基質濃度との大小関係によって、次の3つの状況にわけて表される(酵素量は一定とする)。
- 基質濃度:[S] << Km
式:v=(Vmax/Km)×[S]
反応速度:基質濃度に比例→一次反応 - 質濃度:[S] = Km
式:v=Vmax/2
反応速度:最大反応速度Vmaxの1/2 - 基質濃度:[S] >> Km
式:v=Vmax
反応速度:基質濃度に関係なく一定(Vmax)→零次(0次)反応
KmおよびVmaxの測定
- ミカエリス・メンテンの式の逆数をとって変形すると、次のラインウィーバー・バークの式が求まる。
- ラインウィーバー・バークの式:1/v=(Km/Vmax)×(1/[S] )+(1/Vmax)
- ラインウィーバー・バークの式は、KmおよびVmaxを実験的に測定するときに用いる。
- 基質濃度を変えながら反応速度を測定し、横軸に1/[S]、縦軸に1/vをとってプロットしたものを二重逆数プロットという。これらのプロットを通る直線を描いたとき、この直線と横軸との交点が-1/Km、縦軸との交点が1/Vmaxとなることから、KmおよびVmaxが求められる。
酵素反応の阻害
- 酵素反応の進行を妨げることを阻害といい、これに寄与する化合物を阻害剤という。
- 阻害の種類によって、酵素反応速度は次のように振る舞う。
- 競合阻害
阻害剤の結合部位:基質と同一の酵素の部位(活性中心)
Kmの変化:大きくなる
Vmaxの変化:変わらない - 非競合阻害
阻害剤の結合部位:基質と異なる酵素の部位
Kmの変化:変わらない
Vmaxの変化:小さくなる - 不競合阻害
阻害剤の結合部位:酵素-基質複合体
Kmの変化:小さくなる
Vmaxの変化:小さくなる
酵素活性の測定と単位
- 国際単位(IU):1分間に1 μmolの基質を変化させる酵素量を1 U(1 unit、1単位)とする。
- SI単位:1秒間に1 molの基質を変化させる酵素量を1 katalとする。
- 酵素1 mg当たりの単位時間の基質変化量を比活性という。
- 酵素活性の測定は一定の条件下で行う→最適温度、最適pH、十分に高い基質濃度(零次反応)、反応初速度




不競合阻害のところですが、ピンクの枠のところの表記が非競合阻害になっています。
匿名さん、こんにちは。
当ブログをご覧いただきありがとうございます。
ご指摘のとおり誤植がありましたので修正させていただきました。
貴重なご指摘をいただきありがとうございました。