気になる生化学シリーズ、今回は酵素の1回目として、酵素の働きと性質のお話です。
今回のクエスチョンはこちら、
- 酵素はなにをしているの?
- 酵素はなにでできているの?
- 温度やpHが変わると酵素の働きはどうなるの?
- 酵素の補因子にはなにがあるの?
こうした問いに答えられるよう解説したいと思います。
酵素の働き
酵素は生体内の化学反応において触媒として働く物質です。
触媒とは、化学反応を促進する働きをもつ物質のことで、反応速度を大きくする一方で、それ自身は反応の前後で変化しないという特徴があります。酵素のことを生体触媒、酵素が触媒する反応を酵素反応といいます。
自然界で起こる化学反応では、物質は自由エネルギーが低くなるほうへ変化するという原則があります。つまり、化学反応する前の物質(反応物)に比べ、化学反応後に生成される物質(生成物)のほうが、自由エネルギーが低くなります。
しかし、化学反応が進行するには、反応物がいったん遷移状態(化学反応をしやすい状態)を通過する必要があります。この遷移状態に変わるのに(活性化するのに)必要なエネルギーを活性化エネルギーといいます。活性化エネルギーは、いわば化学反応が進むために越えなければならないエネルギーの壁です。化学反応が起こるには、活性化エネルギーを超えるエネルギーが、熱などで外から与えられなければなりません。
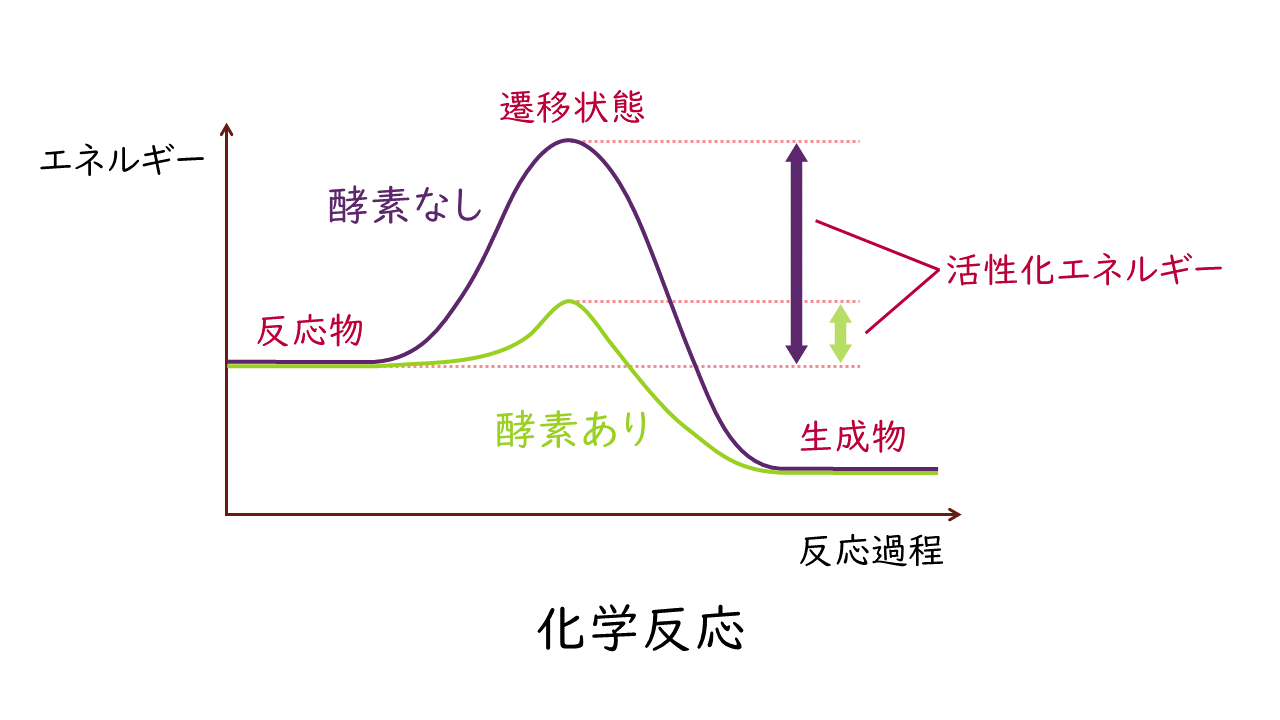
このような化学反応において、酵素(触媒)は活性化エネルギーを小さくする力を持ちます。酵素の働きによって活性化エネルギーが減少することで、反応物が遷移状態に変わりやすくなり、化学反応が促進されます。
酵素の構造と性質
酵素の本体はタンパク質でできています。タンパク質は高次構造を形成しますので、その立体構造が酵素の働きにとって重要な意味を持ちます。
酵素が作用を及ぼす対象(反応物)を基質といいます。酵素は基質と立体的なパズルのように組み合わさることで、触媒としての作用を及ぼします。このとき、基質と結合する酵素の部位を活性中心(活性部位)といいます。活性中心に立体的に配置された官能基と基質の構造が絶妙にあてはまることによって、活性化エネルギーが小さくなると考えられます。
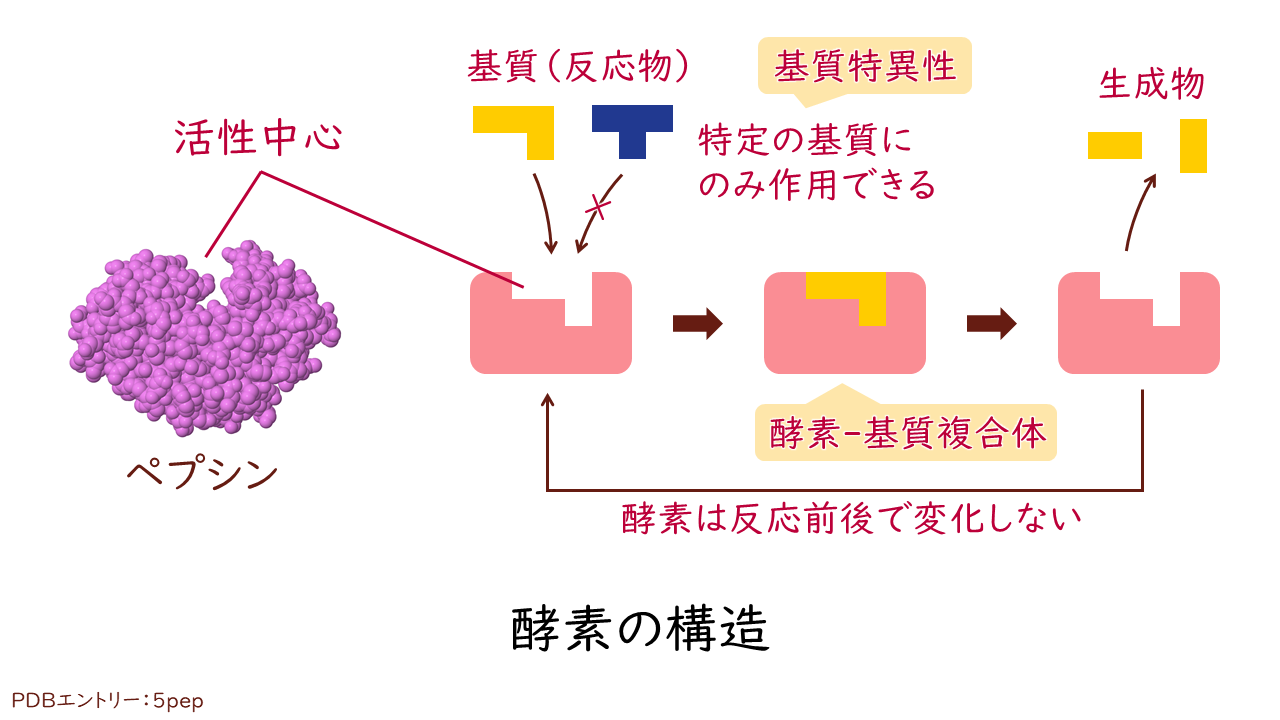
このような構造から、酵素は活性中心にあてはまる特定の基質にのみ作用することができます。この性質を基質特異性といいます。また、酵素が触媒する反応も特定の1つの反応に限られ、これを反応特異性といいます。
例えば、乳酸脱水素酵素の基質は乳酸、触媒する反応は酸化還元反応と決まっています。
酵素反応の条件
酵素反応では、様々な条件の影響を受けて反応速度が変化します。
酵素がタンパク質でできていることによって、無機触媒とは大きく異なる特徴を示します。
温度
温度は活性化エネルギーを与える重要な要素です。よって、一般に化学反応は温度が高いほど反応速度が大きくなります。そのため、無機触媒を用いた化学反応では、温度に比例して反応速度が大きくなります。
しかし、酵素はタンパク質でできています。タンパク質の性質でお話したように、タンパク質は高温になると変性する性質があります。よって、酵素が触媒する反応では、低温領域では温度に比例して反応速度が大きくなるものの、高温領域になるとタンパク質が変性し、酵素活性が失われます(失活する)。
このような性質から、タンパク質の構造に影響を及ぼさない最大の温度において、酵素活性が最も高くなり、反応速度が最大になります。この温度を酵素の最適温度(至適温度)といいます。
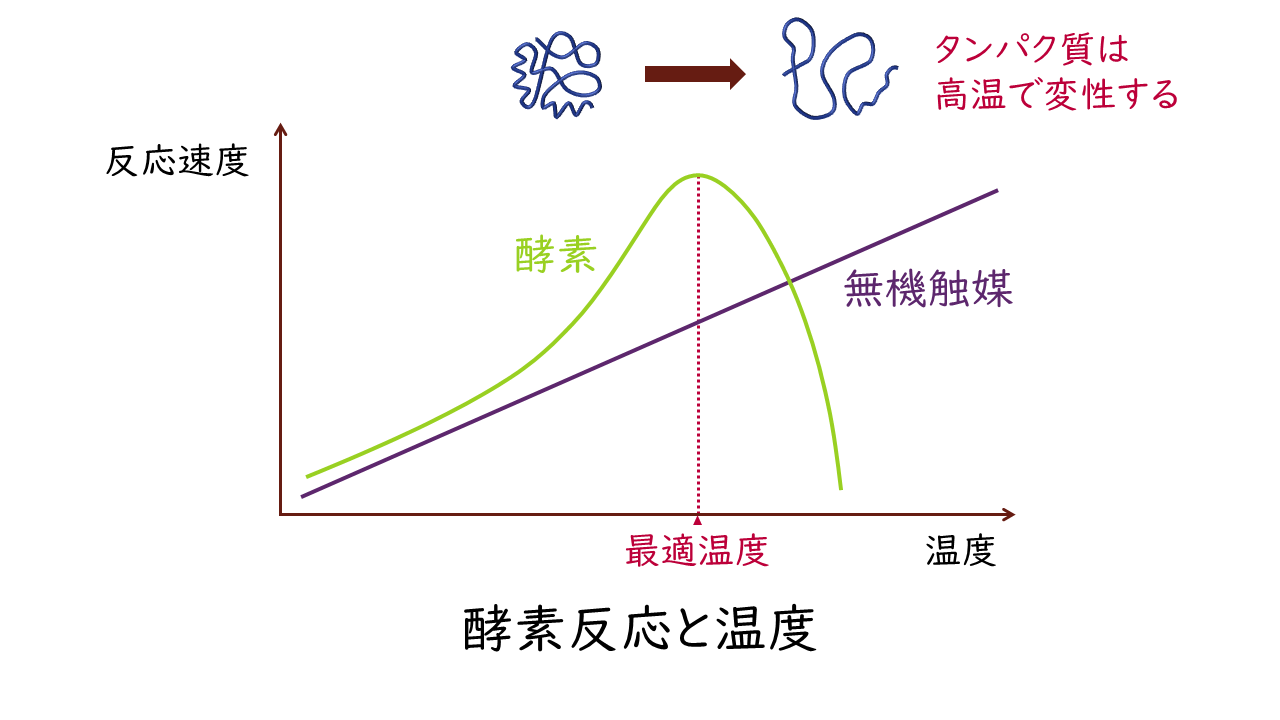
最適温度は生物の生活環境に適応しています。例えば、ヒトの体内にある酵素では、体温の37℃付近が最適温度となっていますが、火山の火口付近に生息する高熱細菌では、100℃付近が最適温度の酵素を利用しています。
一般に、高温で構造に影響を受けない範囲であれば、温度が1℃上昇すると反応速度は約10%上がります。また、10℃上昇するごとに反応速度は1.5~3倍になることが知られています。
pH
溶液のpHもまた、タンパク質に影響を与える要因です。タンパク質の性質でお話したように、pHが変化するとタンパク質表面の荷電状態が変化し、その結果、酵素タンパク質の立体構造や基質との相互作用に変化が生じます。
そのため、それぞれの酵素にとって基質に作用するために最適なpHにおいて、酵素活性が最も高くなり、反応速度が最大になります。このpHを最適pH(至適pH)といいます。
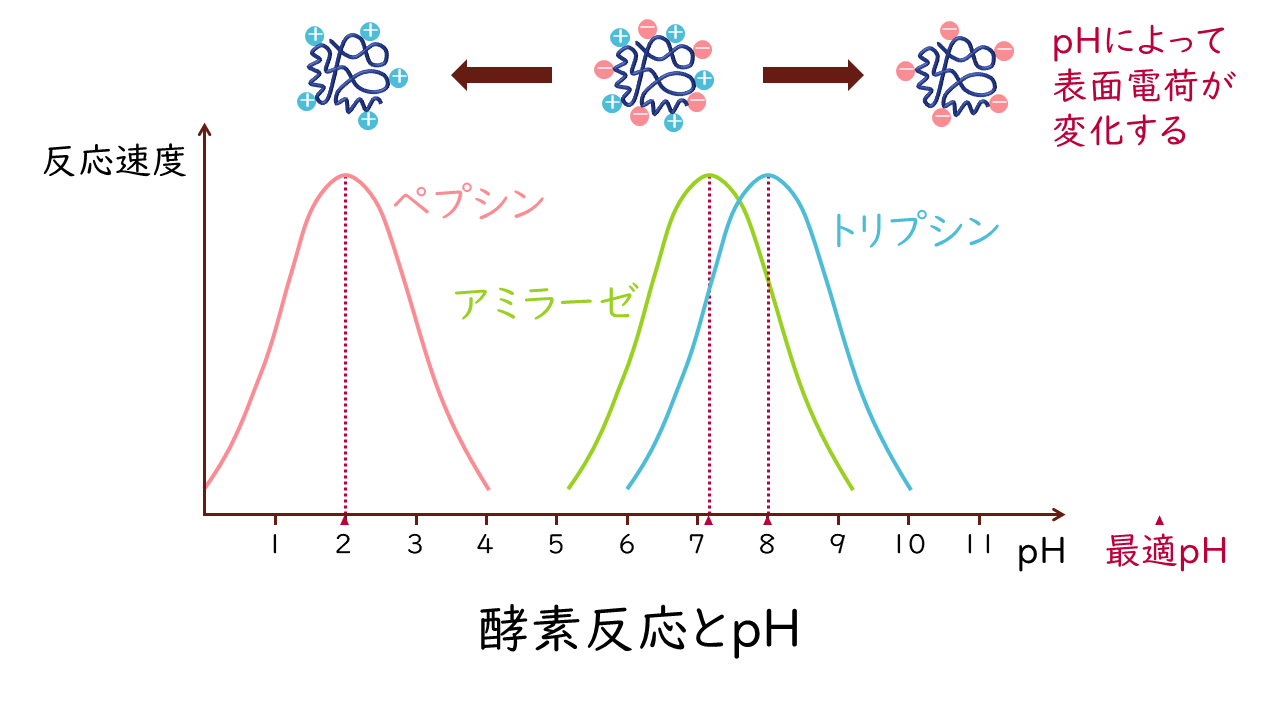
最適pHは酵素の作用する環境に関連しています。例えば、胃液中で働くペプシンはpH2付近、膵液中で働くトリプシンはpH8付近が最適pHとなっています。
補因子
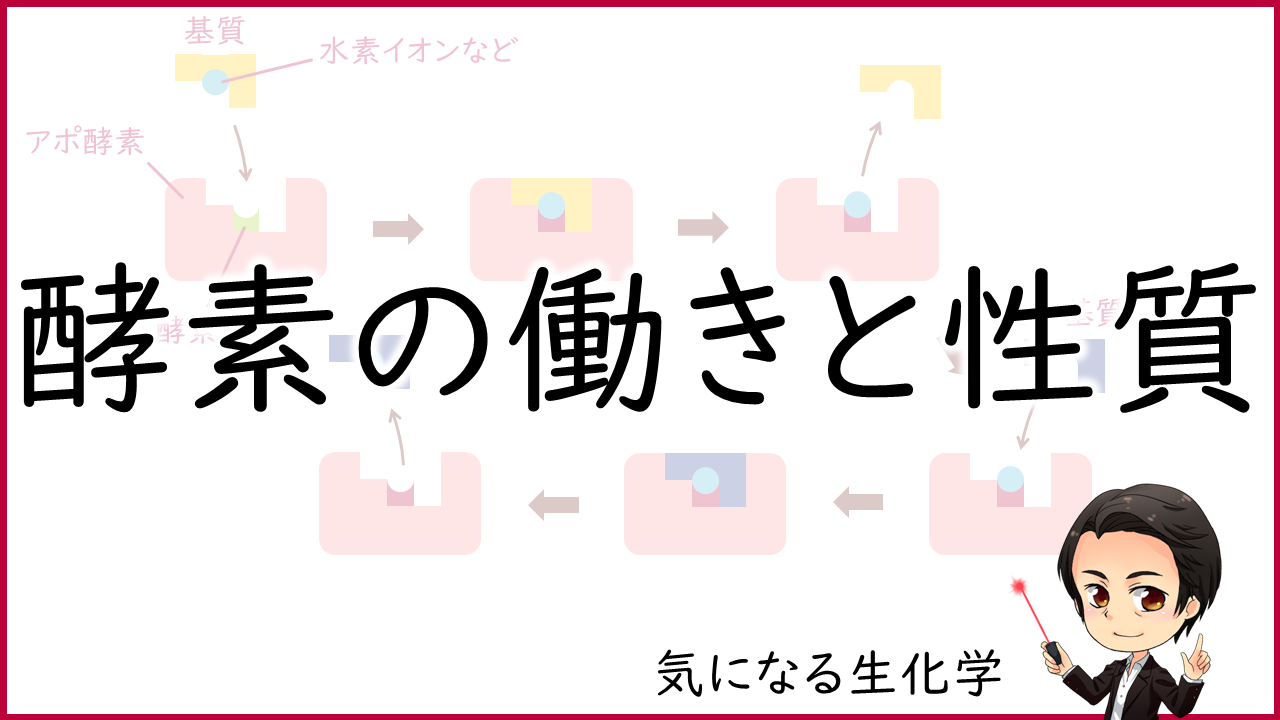
酵素の本体はタンパク質でできていますが、補因子と呼ばれるタンパク質以外の低分子化合物や金属イオンと結合して活性を発揮する酵素も多くあります。これらの補因子は、基質との結合や触媒作用に直接関与しています。
補因子を必要とする酵素では、酵素本体のタンパク質部分をアポ酵素、補因子と結合して活性をもつ酵素全体をホロ酵素といいます。
アポ酵素+補因子=ホロ酵素
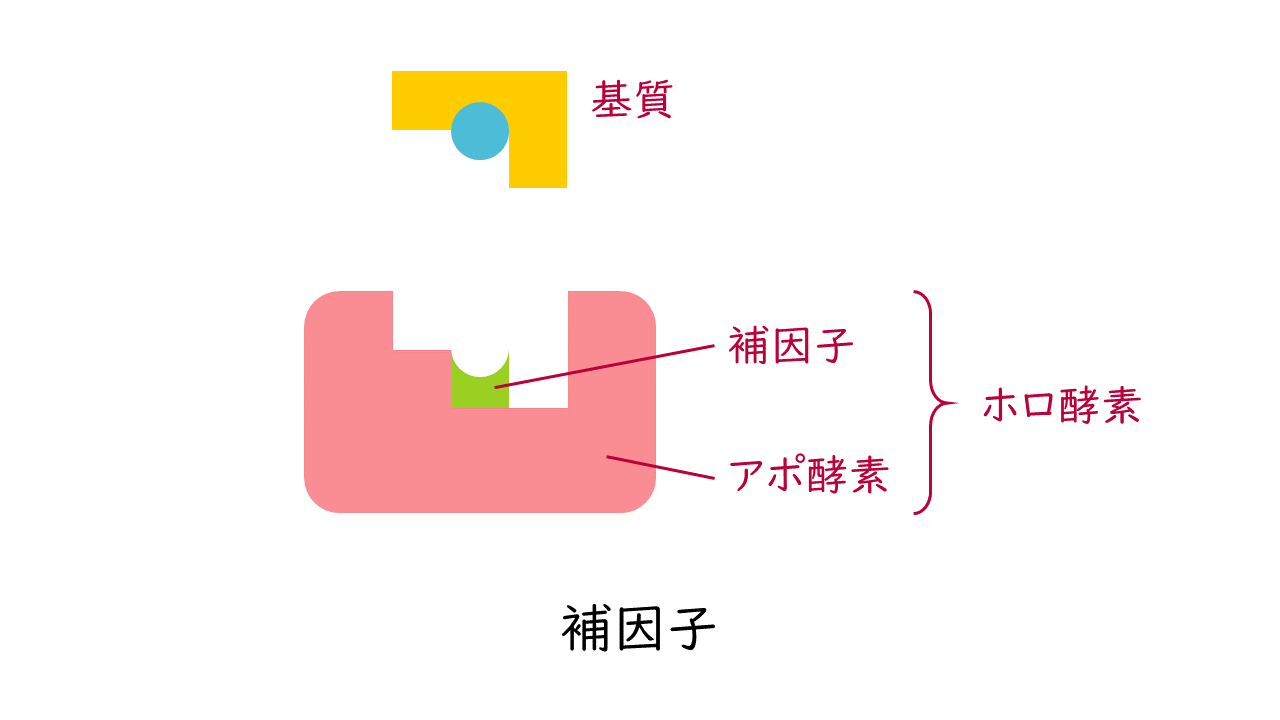
補因子の種類として、補酵素、補欠分子族、金属イオンがあります。
補酵素(coenzyme)
補酵素は、アポ酵素と弱く結合する化合物で、活性中心に結合して酵素反応に直接関与します。補酵素は、基質への作用を補助し(補助基質)、水素や置換基などを運搬する役割を果たします。
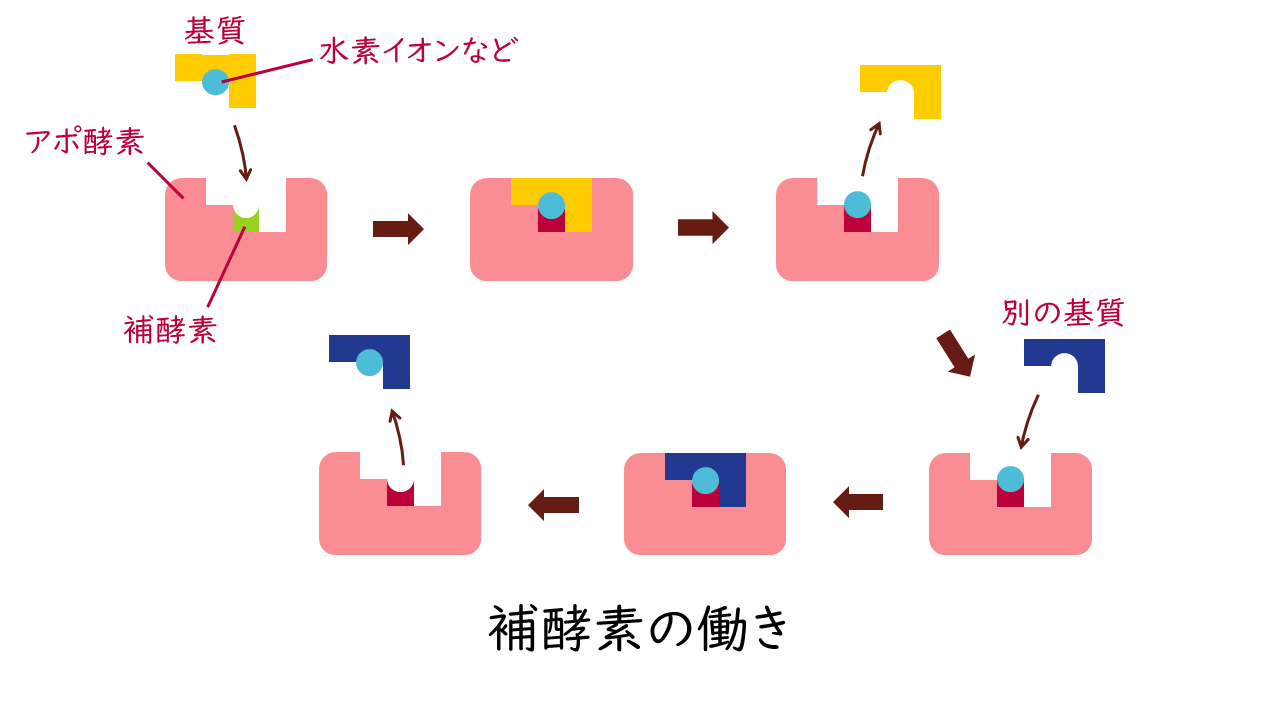
例えば、NADやNADPは脱水素酵素(デヒドロゲナーゼ)の酸化還元反応において、水素イオンを安定化して運搬するために働きます。
そのほかの補酵素として、TDP、FAD、CoA、PLP、THFなどがあり、これらの多くはビタミンB群に由来します。
基質や作用が異なる酵素でも、同様の運搬であれば共通の補酵素が用いられることも多くあります。
補酵素の性質としては、熱に比較的安定です。アポ酵素との結合が弱く、容易に解離しますので、透析によって除去されます。
補欠分子族
補欠分子族は、共有結合や非共有結合でアポ酵素と強く結合している補因子です。補酵素と異なり、透析によって除かれません。
例えば、ヘムなどが補欠分子族として働くほか、ピリドキサールリン酸、FMN、FAD、ビオチンなども補欠分子族として働くことがあります。
金属イオン
金属イオンもまた、酵素への基質の結合や反応に関与することがあります。
そのうち、金属イオンが活性中心に強く結合している酵素を金属酵素、作用時に一時的に結合するだけの酵素を金属活性化酵素といいます。
使われる金属イオンには二価の金属イオンが多く、例えば、Ca2+、Mg2+、Co2+、Cu2+、Mn2+、Zn2+などの金属イオンが使われています。
金属活性化酵素では、反応溶液の中に金属イオンが存在している必要があります。そのため、二価金属イオンを補足・除去する働きをもつEDTA(エチレンジアミン四酢酸)などを添加すると、酵素活性が失われます。
今回のポイント
酵素の働き
- 酵素は生体内の化学反応において触媒として働く(生体触媒)。触媒は、反応速度を大きくするが、それ自体は反応の前後で変化しない。
- 反応前の物質を反応物、反応により生じる物質を生成物や産物という。
- 反応が進行するには遷移状態を通過する必要があり、基質が化学反応しやすい遷移状態に変わるのに必要なエネルギーを活性化エネルギーという。酵素(触媒)は活性化エネルギーを小さくする。
酵素の構造と性質
- 酵素の本体はタンパク質からなり、その立体構造が働きに重要な意味をもつ。
- 酵素が作用を及ぼす対象(反応物)を基質といい、基質と結合する酵素の部位を活性中心(活性部位)という。活性中心に立体的に配置された官能基と基質の構造が絶妙にあてはまることによって、活性化エネルギーが小さくなる。
- 酵素は活性中心にあてはまる特定の基質にのみ作用することができる→基質特異性。また、酵素が触媒する反応も特定の1つの反応に限られる→反応特異性。
酵素反応の条件
- 酵素はある特定の温度でもっとも高い活性を示す。これは一般的に化学反応は温度が高くなるほど反応速度が大きくなる一方で、高温では酵素を構成するタンパク質が変性するため活性が失われる(熱変性による失活)という2つの要因が重なり合った結果である。
- 酵素活性が最も高くなり、反応速度が最大になる温度を酵素の最適温度(至適温度)という。例)動物の酵素:35~50℃
- 一般に温度が1℃上昇すると反応速度は約10%上がる。また、10℃上昇するごとに反応速度は1.5~3倍になる。
- 酵素は、狭い範囲のpH条件でないと活性を示さない。これはpHによって酵素タンパク質の立体構造や酵素と基質の相互作用の変化が起こるためである。最大の酵素活性を示すpHを最適pH(至適pH)という。
例)ペプシン(胃液中)→pH2、トリプシン(膵液中)→pH8
補因子
- 酵素には、補因子と呼ばれるタンパク質以外の低分子化合物や金属イオンと結合して活性を発揮する酵素がある。補因子を必要とする酵素では、酵素本体のタンパク質部分をアポ酵素、補因子と結合して活性をもつ酵素全体をホロ酵素という。∴アポ酵素+補因子=ホロ酵素
- 補因子には補酵素、補欠分子族、金属イオンがある。
- 補酵素(coenzyme):アポ酵素と弱く結合する化合物で、活性中心に結合して酵素反応に直接関与する。補酵素は、基質への作用を補助し(補助基質)、水素や置換基などを運搬する役割を果たす。基質や作用が異なる酵素でも、同様の運搬であれば共通の補酵素が用いられることも多い。熱に比較的安定。アポ酵素との結合が弱く、容易に解離するため、透析によって除去される。多くはビタミンB群に由来する。
例)NAD、NADP、TDP、FAD、CoA、PLP、THF - 補欠分子族:アポ酵素と強く結合し、透析によって除かれない。例)ヘム
- 金属イオン:金属イオンを活性中心に強く結合している酵素(金属酵素)や、作用時に一時的に結合する酵素(金属活性化酵素)。後者ではEDTAなどにより二価金属イオンを補足・除去すると、酵素活性が失われる。
例)Ca2+、Mg2+、Co2+、Cu2+、Mn2+、Zn2+