気になる生化学シリーズ、今回はタンパク質の4回目として、タンパク質の性質をみていきましょう。
アミノ酸が多数つながってできるタンパク質は全体としてどのような性質を示すでしょうか。構成するアミノ酸の影響もありそうです。
今回のクエスチョンはこちら、
- 水に溶けたタンパク質はどうなってるの?
- タンパク質の変性ってどうなること?
- タンパク質はどうやって検出されるの?
こうした問いに答えられるよう解説したいと思います。
タンパク質の溶解
アミノ酸の性質では、アミノ酸単体が両性電解質である様子を説明しましたが、タンパク質全体としても両性電解質としての性質を示します。タンパク質は多くのアミノ酸で構成されますので、側鎖に酸性基をもつものもあれば、塩基性基をもつものも存在しているからです。
タンパク質によって構成するアミノ酸は異なっていますが、酸性アミノ酸含量が多いタンパク質は全体として陰イオンになりやすく、塩基性アミノ酸含量が多いタンパク質は全体として陽イオンになりやすくなります。
そして、これらのイオン化の状態は溶液のpHによって荷電状態が変化します。こうした性質から、アミノ酸と同様に、タンパク質全体としてもそれぞれ固有の等電点(pI)を持ちます。
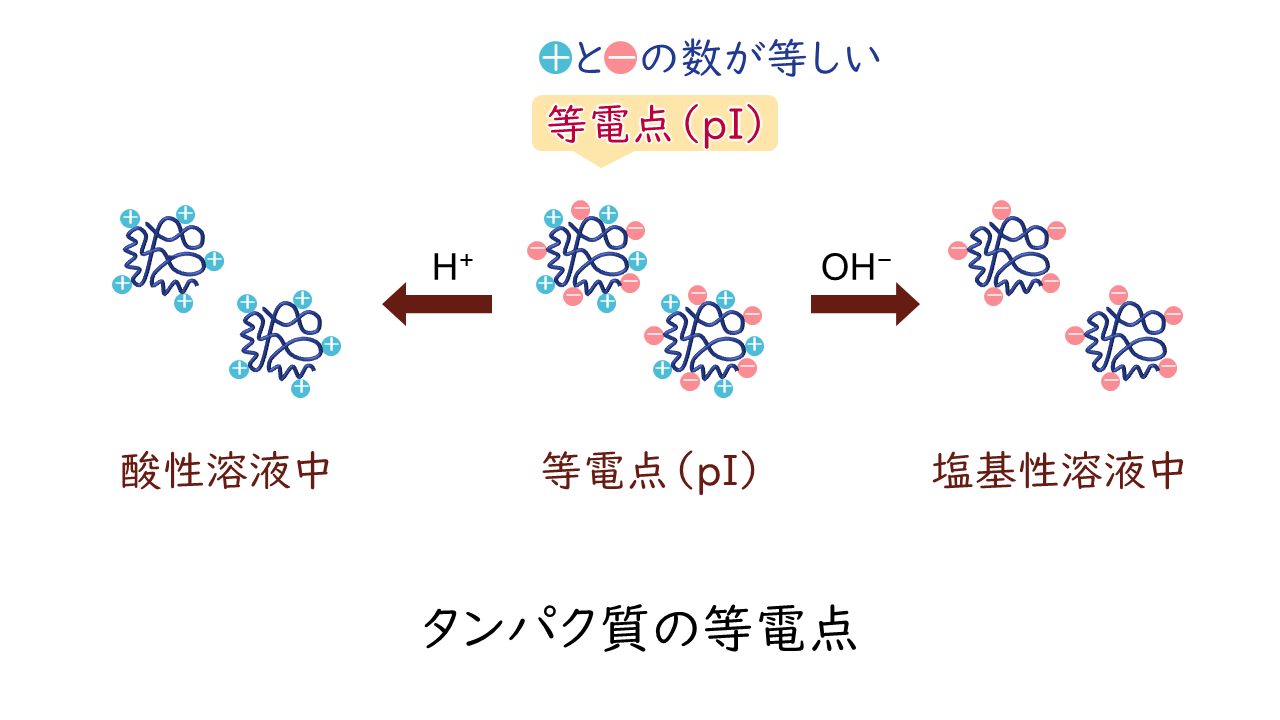
等電点においては、タンパク質表面の電荷が+と-で打ち消されてなくなりますので、タンパク質分子間の反発力が最も小さくなります。そのため、分子間の引力によってタンパク質が凝集が起こり、溶解度が最も低くなります。このようなタンパク質の性質を利用して、pHを等電点付近に調整して目的タンパク質を沈殿させて分離する手法を等電点沈殿法といいます。
逆に、等電点から離れたpHでは、タンパク質表面の電荷が強く、分子間に反発力が生じます。さらに、その電荷によって多数の水分子が表面に親和し、親水コロイドとしてふるまいますので、水への溶解性が高まります。そこに、多量の塩類(電解質)を加えると、コロイドの周りの水分子が取り除かれ、タンパク質が沈殿します。この操作を塩析といいます。
タンパク質の変性
タンパク質はそれぞれ固有の立体構造を形成することで、目的の機能を発揮できます。
生体内で作られるときは、シャペロンなどによって適切な立体構造が形成されますが、その後、環境の変化によって立体構造が変化してしまった場合には、タンパク質は機能を失ってしまいます(失活する)。
立体構造が破壊される原因としては、熱、紫外線、超音波、酸、アルカリ、界面活性剤、有機溶媒、変性剤、重金属イオンなどがあります。しかし、共有結合からなるタンパク質の一次構造は切断されにくいため、多くの場合は非共有結合からなる二次構造(水素結合)、三次構造(側鎖間相互作用)、四次構造が破壊されます。このように、一次構造は変化せずに、高次構造が破壊されることをタンパク質の変性といいます。
変性によって崩れてしまったタンパク質の立体構造は、熱や酸などの原因が取り除かれたとしても、変性前と同じ立体構造には戻りません。
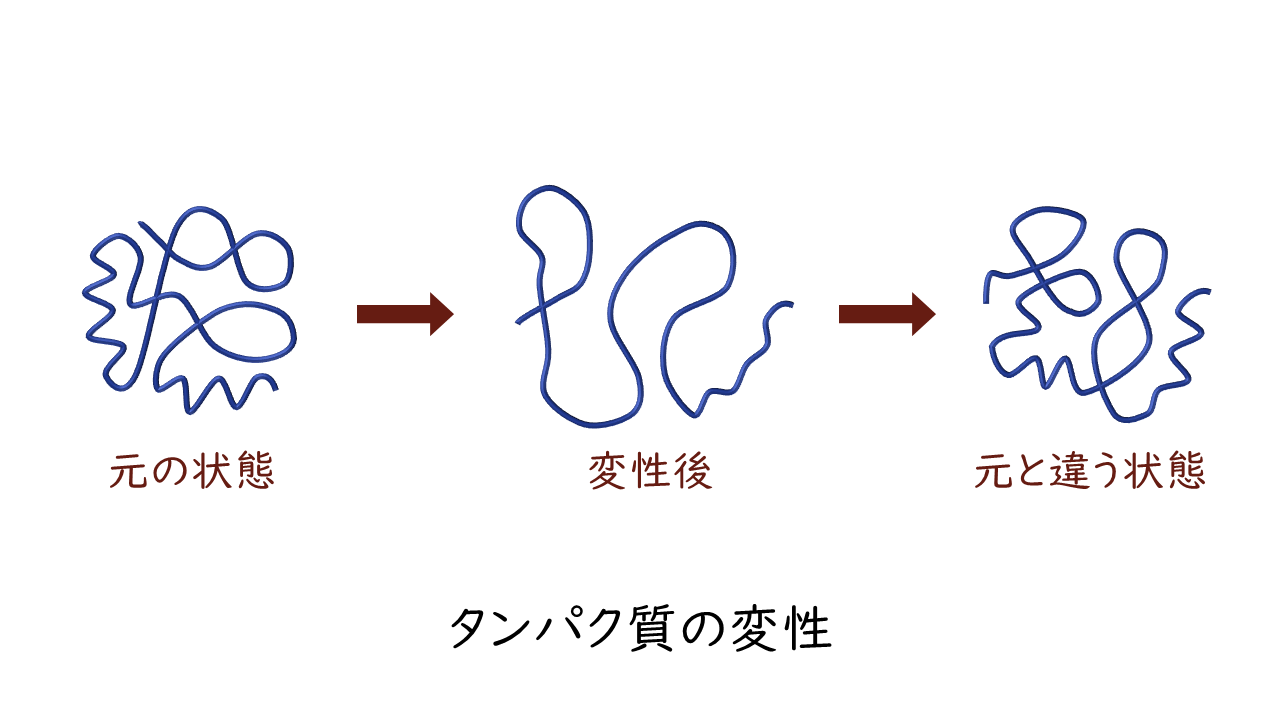
ごくまれに理想的な条件下では変性が可逆的であることもありますが、ほとんどの場合いったん変性したタンパク質は元の構造には戻りません。
また、等電点付近ではタンパク質の溶解度が最も低くなりますので、熱変性を最も受けやすくなります。変性したタンパク質は不溶性であることが多く、沈殿が生じます。
タンパク質の呈色反応
ビウレット反応
アルカリ性溶液中でタンパク質に硫酸銅(Ⅱ)(CuSO4)を加えると、赤紫色(紫紅色、青紫色)の物質が生成されます。
この反応をビウレット反応(Biuret反応)といいます。
ビウレット反応では、ペプチド結合と銅イオン(Cu2+)がキレート結合して赤紫色の錯体を形成します。そのため、呈色はタンパク質中のペプチド結合の数に比例して濃くなります。ジペプチドや単体のアミノ酸(His、Ser、Thrを除く)は陰性となります。
ビウレット反応を利用してタンパク質を定量することをビウレット法といい、吸光度測定には波長545 nmの光が用いられます。ビウレット法では5~160 mg/mLの範囲のタンパク質が定量できます。
ローリー法
ビウレット反応に加え、フェノール試薬を加えると、青色の物質が生成されます。
この反応を利用してタンパク質を定量することをローリー法(Lowry法)といい、吸光度測定には波長700 nmの光が用いられます。ローリー法では1~1500 μg/mLの範囲のタンパク質が定量できます。ビウレット法に比べて感度が高い呈色法です。
フェノール試薬(Folin-Ciocalteu試薬)に含まれるリンタングステン酸とリンモリブデン酸は、還元性側鎖をもつアミノ酸(チロシン、トリプトファン、システイン)によって還元され、青色を呈します。
BCA法
ビウレット反応と同様にアルカリ性条件下でタンパク質と銅イオンの錯体を形成したところに、ビシンコニン酸(BCA)を加えると、青紫色の錯体が形成されます。
この反応を利用してタンパク質を定量することをBCA法といい、吸光度測定には波長562 nmの光が用いられます。BCA法では1~2000 μg/mLの範囲のタンパク質が定量できます。ビウレット法やローリー法に比べて感度が高い呈色法です。
この反応では、タンパク質中の還元性側鎖をもつアミノ酸(チロシン、トリプトファン、システイン)によって銅イオン還元され(Cu2+→Cu+)ます。その銅イオン(Cu+)がBCAと配位結合することで青紫色を呈します。
ブラッドフォード法
酸性溶液中でタンパク質にクマシーブリリアントブルー色素(CBB)を加えると、赤茶色から青色に色が変化します。
この反応を利用してタンパク質を定量することをブラッドフォード法(Bradford法)といい、吸光度測定には波長595 nmの光が用いられます。ブラッドフォード法では10~2000 μg/mLの範囲のタンパク質が定量できます。
CBBは、塩基性アミノ酸残基(リシン、アルギニン、ヒスチジン)との静電的相互作用や、芳香族アミノ酸残基(フェニルアラニン、チロシン、トリプトファン)との疎水性相互作用によって、タンパク質と非共有結合的に結合します。遊離のアミノ酸や低分子のペプチドは陰性となります。
キサントプロテイン反応
タンパク質に濃硝酸を加えて加熱すると、黄色のニトロ誘導体が生成されます。
これをキサントプロテイン反応といいます。
キサントプロテイン反応は、ベンゼン環をもつアミノ酸に特異性があります。
紫外線吸収
タンパク質は紫外線を吸収する性質があります。
これは構成する芳香族アミノ酸(特にチロシン、トリプトファン)に起因するもので、吸収スペクトルでは波長280 nm付近の紫外線に吸収極大を示します。
これを利用してタンパク質を定量することを紫外部吸収法といい、吸収極大の波長280 nmの紫外線を吸光度測定に用います。
今回のポイント
タンパク質の溶解
- タンパク質は酸性アミノ酸も塩基性アミノ酸も含むため両性電解質としての性質を示す。酸性アミノ酸含量が多いと陰イオンになりやすく、塩基性アミノ酸含量が多いと陽イオンになりやすい。
- タンパク質はそれぞれに固有の等電点(pI)をもつ。pI付近ではタンパク質の溶解度が最も低くなる。
- 水溶液中のタンパク質は表面に水分子を親和し親水コロイドとしてふるまう。これに多量の塩類(電解質)を加えるとコロイドの周りの水分子が取り除かれ、タンパク質が沈殿する。この操作を塩析という。
タンパク質の変性
- 一次構造は変化せずに、高次構造が破壊されることをタンパク質の変性という。
共有結合からなるペプチド結合は切断されず、非共有結合のみが切断される。 - 変性の原因には、熱、酸、アルカリ、界面活性剤、有機溶媒、重金属イオンなどがある。
- 変性するとタンパク質は機能を失う(失活する)。理想的な条件下では変性が可逆的であることもあるが、ほとんどの場合いったん変性したタンパク質は元の構造に戻らない。
- 等電点付近ではタンパク質の溶解度が最も低いため、熱変性を最も受けやすい。
- 変性したタンパク質は不溶性であることが多く、沈殿する。
タンパク質の測定(呈色反応、紫外線吸収)
- ビウレット反応:アルカリ性溶液中でタンパク質に硫酸銅(Ⅱ)(CuSO4)を加えると、赤紫色の物質が生成される。吸光度測定波長は545 nm。定量範囲は5~160 mg/mL。ペプチド結合と銅イオン(Cu2+)がキレート結合して赤紫色の錯体を形成する。ジペプチドとアミノ酸(His、Ser、Thrを除く)は陰性。
- ローリー法:ビウレット反応に加え、フェノール試薬を加えると、青色の物質が生成される。吸光度測定波長は700 nm。定量範囲は1~1500 μg/mL。ビウレット法に比べて感度が高い。
- BCA法:アルカリ性条件下でタンパク質と反応して還元された銅イオン(Cu2+→Cu+)が、ビシンコニン酸(BCA)と配位結合して青紫色を呈する。吸光度測定波長は562 nm。定量範囲は1~2000 μg/mL。
- ブラッドフォード法:クマシーブリリアントブルー色素(CBB)がタンパク質と結合し、赤茶色から青色に変化する。吸光度測定波長は595 nm。定量範囲は10~2000 μg/mL。クマシーブリリアントブルー法ともいう。
- タンパク質は紫外線をよく吸収し、構成する芳香族アミノ酸(特にTyr、Trp)に起因して波長280 nm付近の紫外線に吸収極大を示す。