気になる生化学シリーズ、今回はタンパク質の3回目として、タンパク質の構造をみていきましょう。
タンパク質は20種類のアミノ酸がつながってできる高分子有機化合物です。
今回のクエスチョンはこちら、
- ペプチド結合ってどんな結合なの?
- タンパク質の高次構造はどうやってできるの?
- タンパク質はどうやって折りたたまれるの?
こうした問いに答えられるよう解説したいと思います。
ペプチドの形成
アミノ酸とアミノ酸の結合をペプチド結合といいます。
2つのアミノ酸の間で、一方のカルボキシ基ともう片方のアミノ基が結合することでペプチド結合(―CONH―)を形成します。ペプチド結合はアミド結合の一種です。
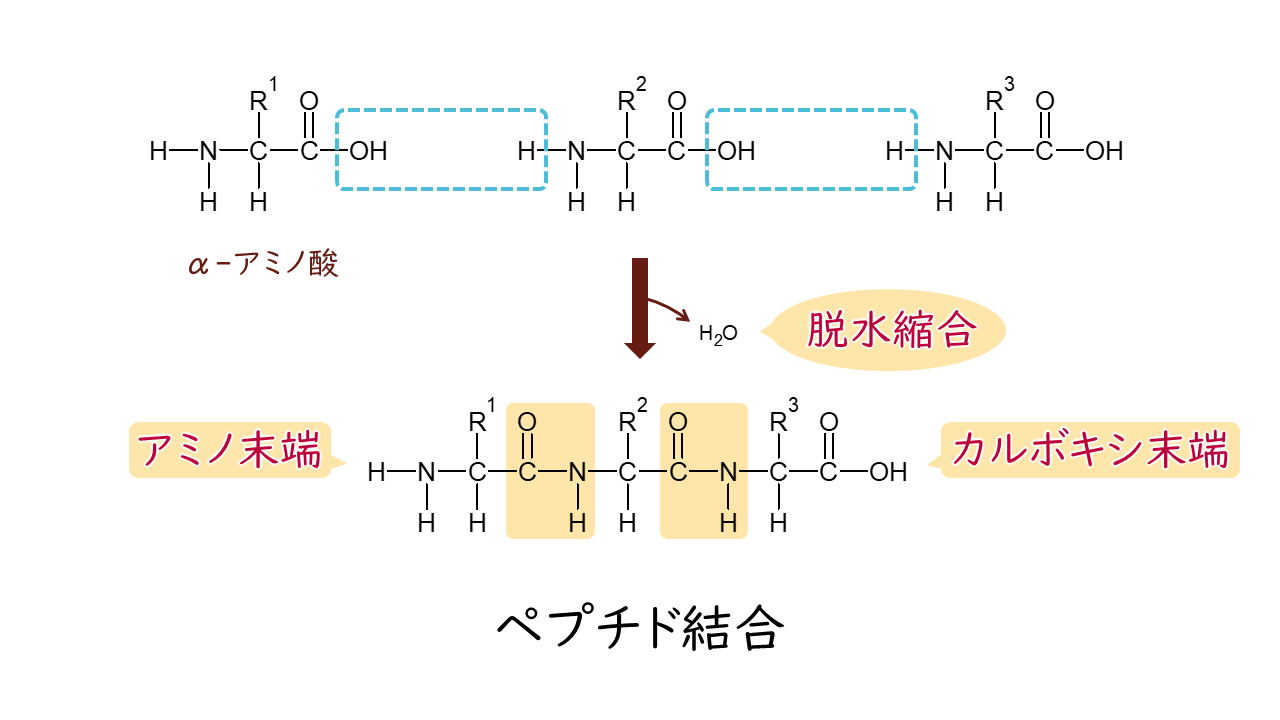
ペプチド結合を形成すると、個々のアミノ酸からは水分子1つ分(H2O)が減っていることになります。よって、ペプチド結合したあとの個々のアミノ酸を指してアミノ酸残基といいます。アミノ酸残基では、側鎖(R)の部分が元のアミノ酸の特徴として性質を発揮します。
こうしてアミノ酸が連結したものをペプチドといい、つながっているアミノ酸の数が2個ならジペプチド、3個ならトリペプチド、数個~十数個程度までならオリゴペプチド、それ以上多数ならポリペプチドと呼びます。
タンパク質は数百から数千個のアミノ酸がつながったポリペプチドで構成されます。ペプチドのなかにはアミノ酸数個~数十個程度からなる単体で特定の働きをもつものもあり、こうしたものを生理活性ペプチドといいます。
一次構造
タンパク質の種類によって、構成するアミノ酸の種類と配列が異なりますが、それらはDNA上に記された遺伝子の塩基配列によって指定されています。こうした、タンパク質を構成するアミノ酸配列そのもののことを、タンパク質の一次構造といいます。
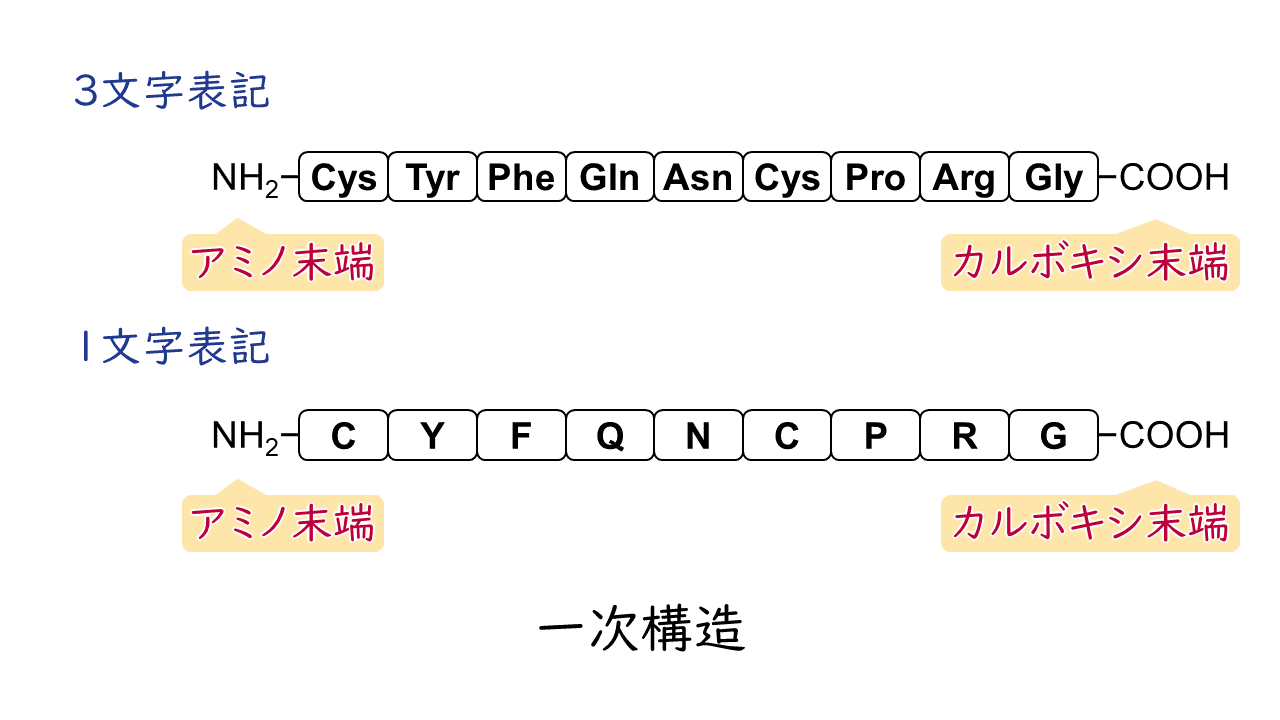
なお、ひとつながりのペプチドにおいて、一方の末端はアミノ基、もう片方の末端はカルボキシ基が残ることになります。このうち、アミノ基が残っている端をアミノ末端(N末端)、カルボキシ基が残っている端をカルボキシ末端(C末端)といいます。
ペプチドのアミノ酸配列を横並びに記述する際、基本的にはアミノ末端を左側に書くようにします。
タンパク質の高次構造
タンパク質の機能は、アミノ酸の配列(一次構造)だけでなく、特定の立体構造を形成することで発揮されます。
ポリペプチド鎖は柔軟に変形できますが、生体内では精密に折りたたまれ、熱力学的に安定した特定の立体構造(立体配座、conformation)をとることで機能しています。
このようなタンパク質の高度な立体構造を高次構造といい、一次構造と区別して二次構造、三次構造、四次構造と段階的に構築されています。
二次構造
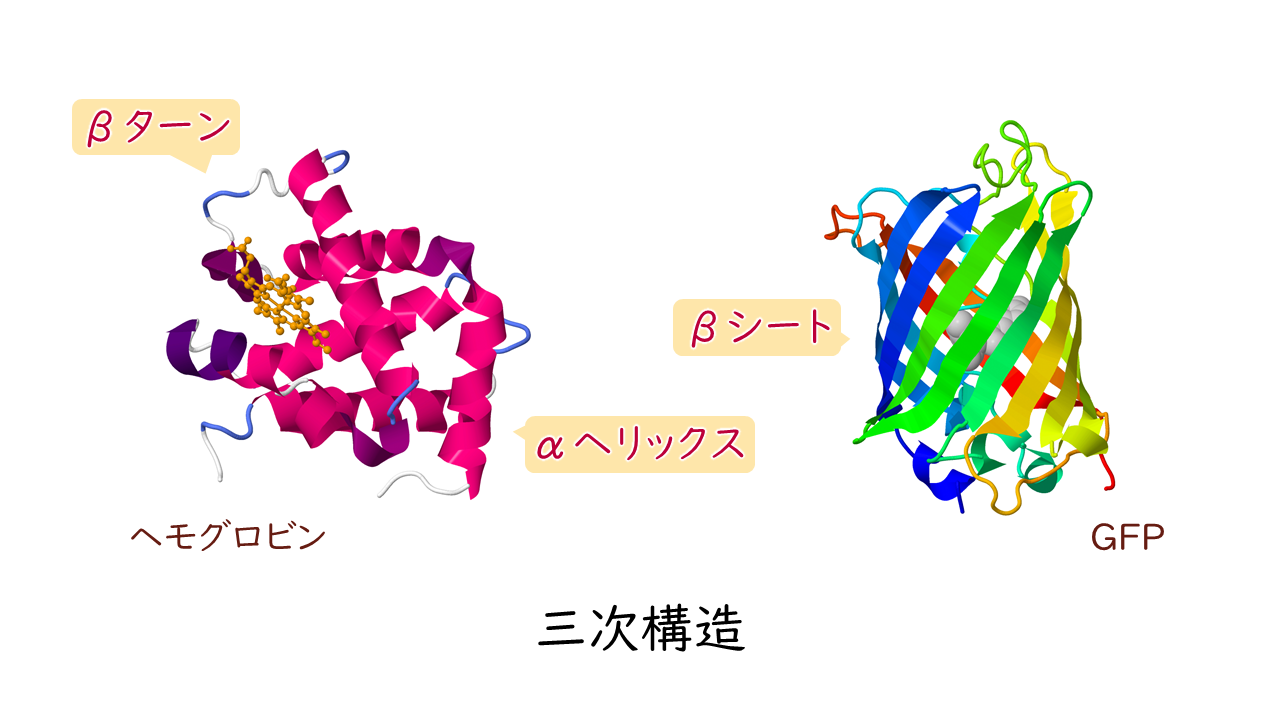
一次構造が形成されたのち、ポリペプチド主鎖の間で形成される規則的な構造として、αヘリックス、βシート、βターンがよく見られます。
これらをタンパク質の二次構造といいます。
二次構造は主に距離が近いアミノ酸同士の水素結合によって形成されます。ただし、アミノ酸の側鎖は関与せず、ペプチド結合に関与しているカルボニル基(―CO―)とアミド基(―NH)の間で、水素結合を形成することによって規則的な構造が形成されます。
αヘリックスは主鎖がらせん状に回転した構造です。
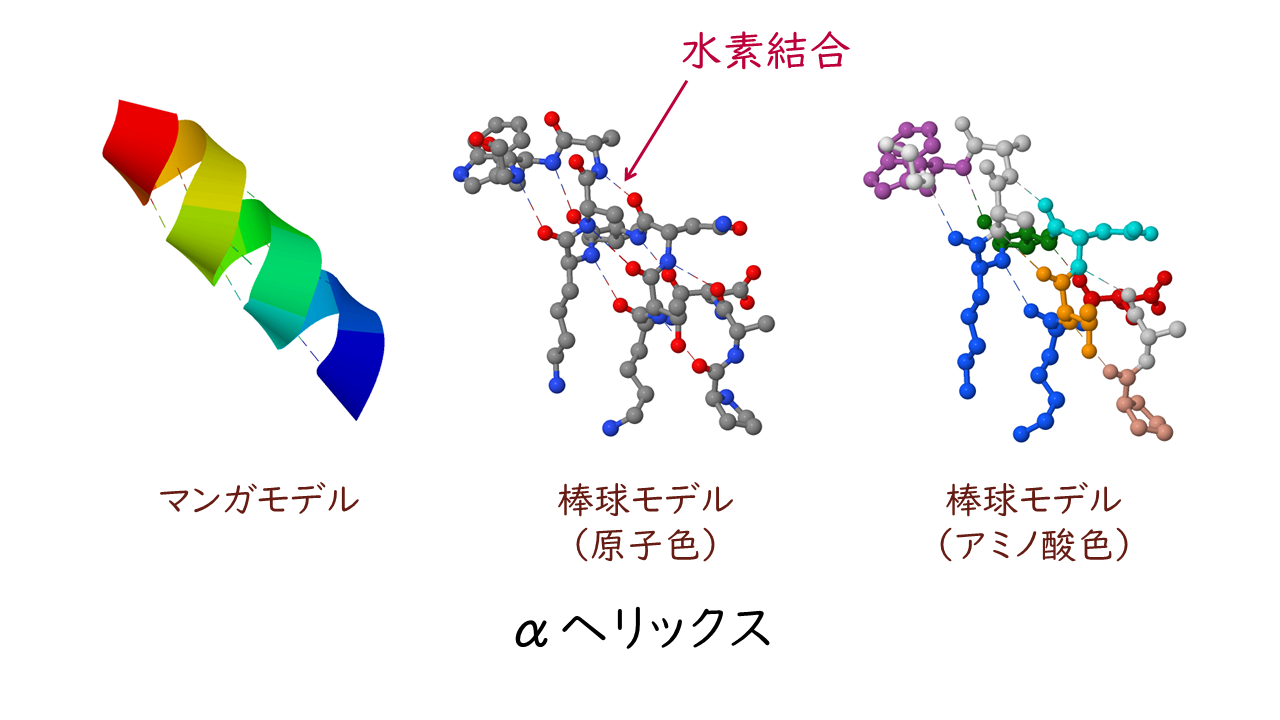
αヘリックスのらせんの巻き方は右巻きになっています。
βシートは主鎖が平面状に少しジグザグしながら伸びた構造です。
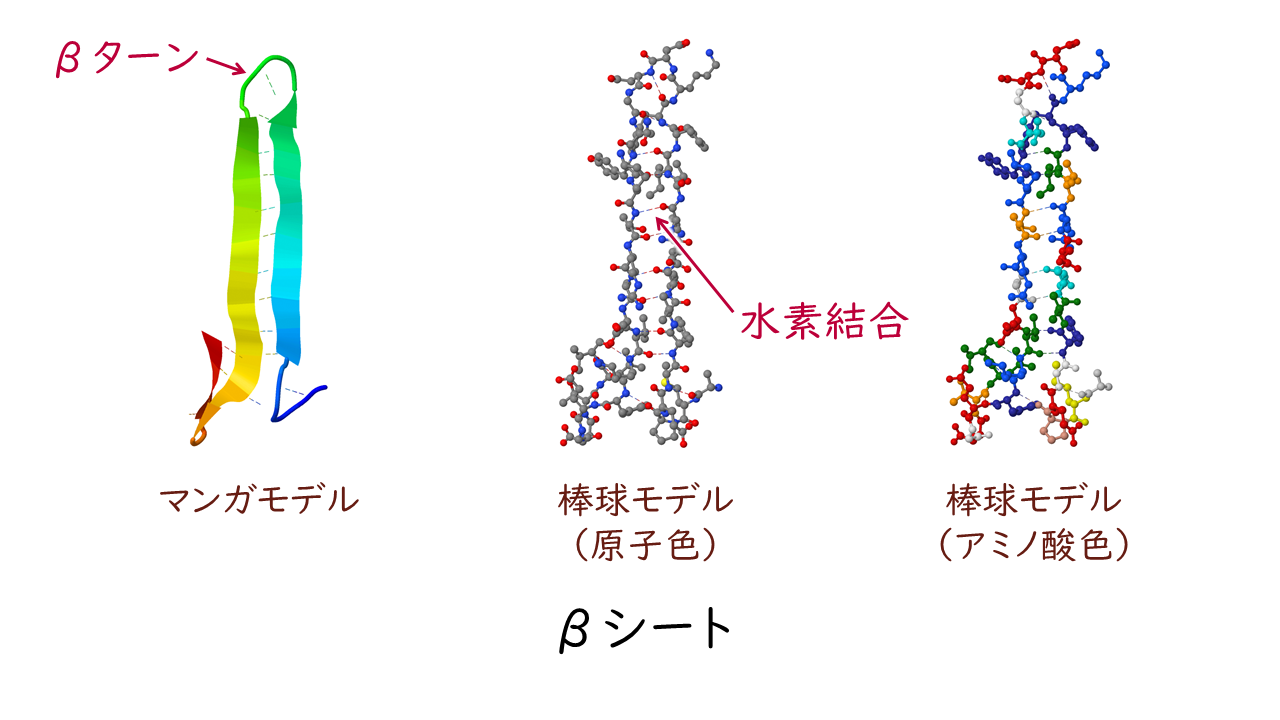 いくつかのβシートが隣り合って並び、隣同士の主鎖の間で水素結合を形成しています。βシートが集まると全体としてひだ状の層になります。
いくつかのβシートが隣り合って並び、隣同士の主鎖の間で水素結合を形成しています。βシートが集まると全体としてひだ状の層になります。
また、αヘリックスやβシートが折り返す部分の構造をβターンといいます。
一方、特徴的な構造を持たない部分はランダムコイルといいます。
アミノ酸側鎖はこれらの構造において結合に関与せず、αヘリックスではらせんの外側に突出し、βシートではシートの両面に互い違いに突き出しています。
三次構造
二次構造を保持しながら、アミノ酸の側鎖どうしが相互作用することで形成されるタンパク質固有の立体構造を三次構造といいます。
熱力学的に安定した特定の三次構造を形成することがタンパク質が機能的に活性であることに欠かせません。
側鎖どうしの相互作用には、水素結合、イオン結合、ジスルフィド結合(S-S結合)、疎水性相互作用があります。
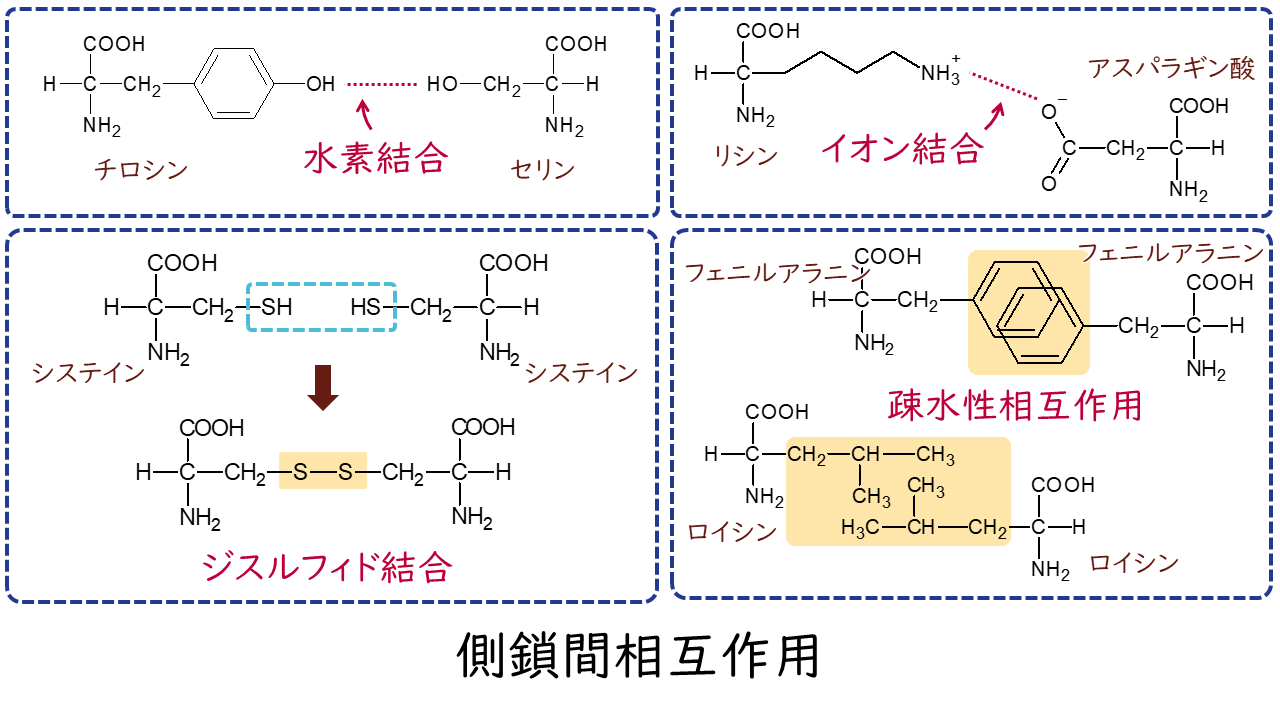
ジスルフィド結合(S-S結合)は、2つのシステインの間で側鎖のSH基が互いに結合することで形成され、ポリペプチド鎖の離れた箇所を架橋する役割があります。
疎水性相互作用は、疎水性をもつ側鎖同士が水分子から排除された結果集まる現象です。
これらの側鎖間相互作用は非共有結合性の弱い相互作用ですが、ポリペプチド鎖のいたるところで形成されることで、タンパク質全体の形が作られるのです。
なお、三次構造では、親水性のアミノ酸側鎖が全体の表面に、疎水性のアミノ酸側鎖が内側に位置するのが一般的です(水溶性タンパク質の場合)。
四次構造
三次構造を形成したポリペプチドが、さらに複数会合して機能する場合の構成や配置のことを四次構造といいます。
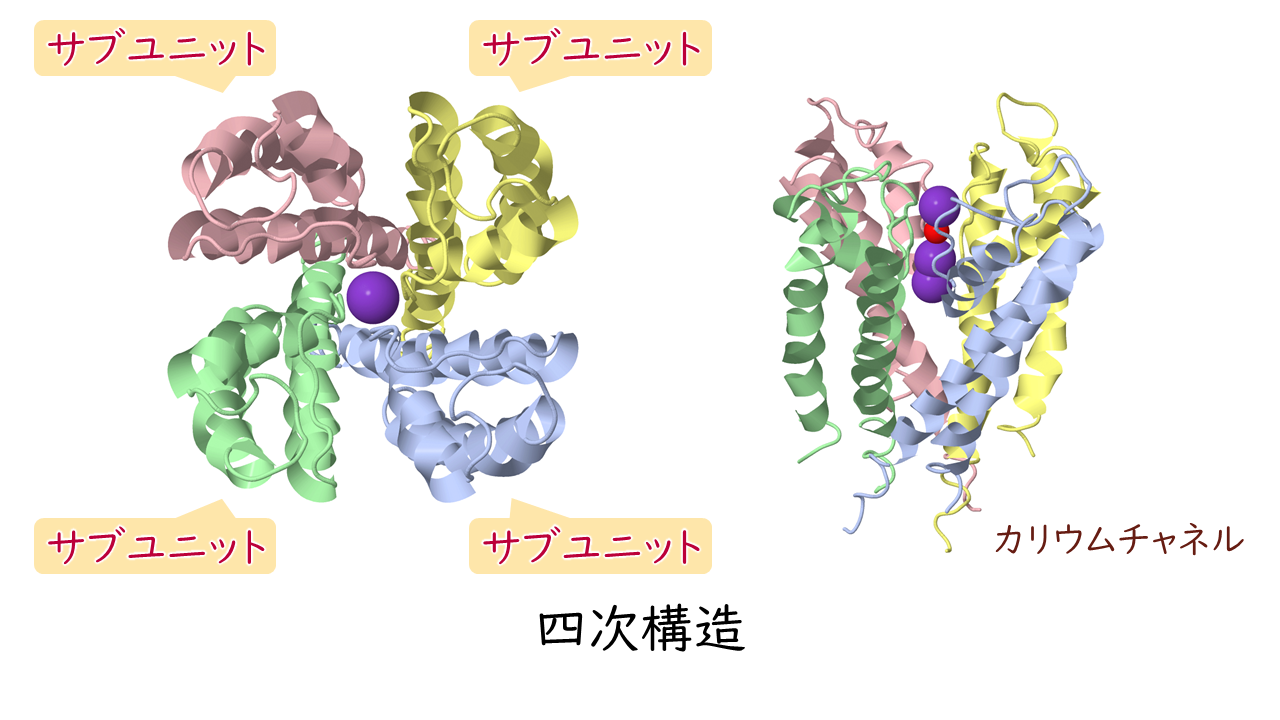
四次構造において、構成する個々のポリペプチド鎖をサブユニットといいます。
また、機能するタンパク質として、2つのサブユニットで構成されるものを二量体、4つのサブユニットで構成されるものを四量体というように呼びます。
折りたたみ
ひも状の一次構造から立体的な三次構造を形成するまでの過程をタンパク質の折りたたみ(フォールディング)といいます。
折りたたみのパターンが膨大にあるなかで、アミノ酸側鎖の相互作用に基づき、熱力学的に最もエネルギー状態の低い安定した構造に落ち着きます。
細胞内でリボソームによってタンパク質が合成されるとき、シャペロンというタンパク質が働き、タンパク質が適切な高次構造に折りたたまれるよう補助しています。
シャペロン(chaperon)という言葉には「付き添い、お目付役、監視人」という意味がありますが、古くヨーロッパでは若い女性が社交界デビューするときに介添えする年上の婦人を指す言葉だったそうです。
ルノワール作『ムーラン・ド・ラ・ギャレット』では、人々の社交の場であったパリ・モンマルトルの丘のカフェを描かれていますが、そのなかにシャペロンと思われる人物が描かれています。

今回のポイント
ペプチド
- アミノ酸同士の結合をペプチド結合という。また、ペプチド結合後の個々のアミノ酸を指してアミノ酸残基という。
- アミノ酸が連結したものをペプチドといい、つながっているアミノ酸の数が十数個程度までならオリゴペプチド、それ以上多数ならポリペプチドという。タンパク質は数百から数千のアミノ酸がつながったポリペプチドで構成される。アミノ酸数十個程度からなる単体のペプチドで特定の働きをもつものを生理活性ペプチドという。
- タンパク質を構成するアミノ酸配列そのもののことをタンパク質の一次構造という。
- ペプチドにおいて、アミノ基が残っている端をアミノ末端(N末端)、カルボキシル基が残っている端をカルボキシ末端(C末端)といい、アミノ酸配列を記述する際はアミノ末端を左側に書く。
タンパク質の高次構造
- ポリペプチド鎖は柔軟に変形できるが、生体内では精密に折りたたまれ、熱力学的に安定した特定の立体構造(conformation)をとることで機能する。タンパク質の立体構造のうち、二次構造~四次構造を高次構造という。
- 二次構造:ポリペプチド主鎖の間で形成される規則的な構造で、主に距離が近いアミノ酸同士の水素結合によって形成される。二次構造として、右巻きらせん構造のαヘリックス、ひだ状層構造のβシート、折り返し部のβターンがある。一方、特徴的な構造を持たない部分はランダムコイルという。アミノ酸側鎖はこれらの構造において結合に関与せず、αヘリックスではらせんの外側に突出し、βシートではシートの両面に互い違いに突き出している。
- 三次構造:個々のタンパク質に固有の三次元構造で、二次構造を保持しながら、アミノ酸側鎖が相互作用することで形成される。水素結合、イオン結合、ジスルフィド(S-S)結合、疎水性相互作用がある。このとき、親水性のアミノ酸側鎖が全体の表面に、疎水性のアミノ酸側鎖が内側に位置する。
- 四次構造:複数のポリペプチド鎖が会合して機能する場合の構成や配置のこと。構成する個々のポリペプチド鎖をサブユニットという。サブユニット2つからなるものを二量体、4つからなるものを四量体という。
- ひも状の一次構造から立体的な三次構造を形成するまでの過程をタンパク質の折りたたみ(フォールディング)という。折りたたみのパターンが膨大にあるなかで、アミノ酸側鎖の相互作用に基づき、最もエネルギー状態の低い安定した構造に落ち着く。細胞内ではシャペロンというタンパク質が働き、タンパク質が適切な高次構造に折りたたまれるよう補助している。





